실험 제목 : Recrystallization : Acid - base properties
실험 목적 : 유기화합물의 용해도와 고체 물질의 정제방법인 재결정에 대한 개념을 배우고 아울러 반응혼합물의 정제방법인 추출 및 산, 염기 성질을 이용한 분리방법과 건조방법 그리고 TLC와 녹는점을 통한 물질의 순도확인에 대해 배운다.
시약 및 기구 : Acetanilide, Benzoic aicd, HCl (1N), 100mL 1-neck rb, 100mL 3-neck rb, Erlenmeyer flask, Clamp & clamp holder, Stirring bar, Separatory funnel, Buchner funnel, Suction flask, Filter paper, pH paper, Pipette & filter, Mass flask, Hot plate, Spatula, Weighing paper, Balance, Aspirator, TLC chamber, Silica TLC plate, Pincette, UV lamp
주의사항
1. 추출 시 solvent를 과량 사용하지 않는다.
2. 산, 염기 사용 시 피부에 닿지 않도록 주의한다.
3. 분액 깔대기를 사용 시 내부압력 benting 할 때는 사람을 향하지 않도록 한다.
시약조사
1. Acetanilide
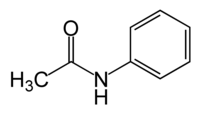

Acetanilide는 얇은 조각 모양을 한 무색의 고체이다. IUPAC name 은 N-phenylacetamide, 분자식은 C6H5NHCOCH3, 분자량 135.17g/mol, 밀도 1.219g/cm³, 녹는점 114.3℃ 이며 22℃의 물에 0.1g/100ml 이하로 녹는다. Acentanilide는 acetic anhydride 와 aniline의 반응을 통해 만들어진다.
C6H5NH2 + (CH3CO)2O → C6H5NHCOCH3 + CH3COOH
이렇게 생성한 순수한 결정은 판모양이며, 무색이다. Acetanilide 는 고무의 중간체 합성을 가속시킬 때, 염료의 중간체 합성을 할 때 쓰인다.
2. Benzoic acid
2. Benzoic acid
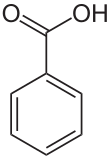
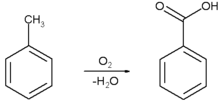
IUPAC name이 Benzoic acid 인 벤조산은 분자식이 C6H5COOH, 분자량 122.12g/mol, 1.32g/cm³, 녹는점 122.4℃, 뜨거운 물에 대해서는 잘녹고 25℃물에는 0.34g/100ml 녹으며, pKa = 4.21 인 무색의 결정성 고체이다. 그리고 가장 간단한 aromatic carboxylic acid 이다. 벤조산은 많은 유기물질의 전구체 합성에 있어서 매우 중요한 물질이다. 벤조산은 16세기에발견되었고, 요즘은 toluene에 partial oxidation을 하여 합성한다.
실험 원리
유기화합물 분리 방법에는 distillation, chromatography, recrystallization, extraction, freeze drying, electrophoresis 등이 있다.
먼저 patitioning이라고도 하는 solvent extraction(추출)은 물과 유기용매처럼 섞이지 않는 다른 두 액체에 대해서 서로 다른 용해도를 가진다는 것을 이용해 물질을 분리하는 방법이다. 이것은 한 액체속에 녹아있는 물질이 다른 액체로 옮겨가는 추출이다. 즉, 적당한 용매를 써서 우리가 얻고자 하는 잘 녹는 물질이 잘 녹지 않는 다른 혼합물로부터 분리된다. 이런 용매를 이용한 추출은 유기화합물의 생성, 향수 생산 공정에 자주 쓰인다. 추출을 할 때 어떤 물질이 얼마나 추출이 잘 되는지를 partition coefficient(분배계수) 또는 distribution ratio 라는 Kp를 정의해서 표현한다.
Kp = 상2에서의 A의 용해도 / 상1에서의 A의 용해도
이 분배 계수는 계에 의존하고, 온도, 계 안의 화학종의 농도에 따라 달라지는 값이다. solvent extraction을 할 때 섞이지 않는 두 액체를 분별깔때기(separatory funnel)에 넣고 흔든다. 분별깔때기에는 크게 cylindrical, squibb, globe 세가지가 있다.

cylindrical |
globe |

squibb |
분별깔때기를 흔들 때, emulsion이 생길 수 있는데 제거하는 방법은 시간을 충분히 두어 오래 놔두던지, demulsifier를 넣거나, centrifuge를 하면 없어진다.
그리고 또 다른 분리방법으로는 Recrystallization(재결정)이 있다. 재결정은 화합물을 정제하는 방법중 하나로써, 우리가 얻고자 하는 화합물 A와 그 화합물 A를 오염시키는 적은 양의 불순물 B가 있다고 하자. recrystallization에는 여러가지가 있는데, Single-solvent, Multi-solvent, Hot-filtration recrystallization 등이 있다. 그중 Single-solvent recrystallization을 할 때 보통 혼합물을 넣기 전에 용매를 따뜻하게 해서 용해도를 높인다. 그리고 혼합물을 넣고 온도를 서서히 낮춘다. 그러면 용액이 식으면서 화합물의 용해도가 떨어지게 된다. 그 결과로 우리가 원하는 화합물 A가 용액으로부터 석출(재결정)된다. 식히는 속도를 천천히 하면 할 수록 점점 더 큰 결정이 형성된다. 일단 용액에서 작은 결정이 형성되면, 그 결정이 점점 자라게 되어 결정이 커지게 된다. 그래서 화합물 A가 용액 안에 포화상태를 넘게 되어 먼저 결정을 형성하고, 불순물은 그대로 용액안에 남게 된다. 이 결과로 얻은 고체는 원래의 혼합물보다 더 순수하다. 순도의 확인은 재결정하여 얻은 고체의 녹는점과 재결정하기 전의 고체의 녹는점을 비교하는 것이다. 순도가 높은 것은 더 낮은 녹는점과 녹는 범위가 좁다. 그리고 효과적인 재결정은 정확한 용매를 찾는 것에 달려있다. 보통 조합을 prediction/experiment 나 trial/error 를 사용하여 찾는다. 그리고 선택한 용매는 높은 온도에서 혼합물을 녹여야만 하고, 낮은 온도에서 우리가 원하는 물질이 녹지 않아야만 한다.
용액에서 염이 용해도에 영향을 주는데, 그 중 하나가 common-ion effect(공통이온효과) 이다. 공통이온효과는 두개의 용질이 공통된 이온을 가지고 있을 때 나타난다. 그리고 공통이온효과는 약산이나 약염기의 이온화를 더 못하게 만들 수 있다. 그 이유는 평형에서의 르샤틀리에의 원리에 의하여 이온이 많아지면 역반응으로 이온화가 되지 않은 것이 많아지기 때문이다.
그리고 또다른 효과는 Salting out(염석 효과)이다. 염석효과는 원래 고농도의 염속에서 단백질이 덜 녹는다는 것을 이용해 분리하는 방법이다. 어떤 한 물질이 소수성인 부분과 친수성인 부분이 공존할 때, 물에 녹는다는 것은 친수성인 부분이 물과의 인력이 작용하여 수화가 된다는 것이다. 그런데 염의 농도가 높아지면 물분자가 염 이온과의 인력이 강해지고 그만큼 녹아있던 물질과의 인력이 약해진다. 그 결과 용질끼리의 인력이 용질과 물의 인력보다 강해지면서 석출되게 된다. 이러한 과정을 염석 효과라고 한다. 하지만 어떤 이온은 농도가 높아지면 물질의 용해도가 증가할 수 있어서 주의해야한다. 어떤 물질을 물로부터 제거할 때 NaCl이 사용되는데, NaCl이 물과의 인력이 작용하여서 전체적으로 극성이 강해진다. 따라서 물질들은 유기용매쪽으로 옮겨가 추출된다.
또 물질을 분리하는 방법 중에는 chromatography가 있는데, 그중에서도 TLC를 자주 사용한다. TLC는 thin layer chromatography로, 주로 유리, 플라스틱, 알루미늄 호일 위에 코팅된 실리카겔이나 알루미나, 셀룰로오스 등이 사용된다. TLC는 주로 반응의 진행을 볼 때, 화합물이 뭔지 알아낼 때, 물질의 순도를 확인할 때 사용한다. TLC를 할 때 용매에 닿는 부분으로부터 1.5cm 위에 시료를 점적하는데, 각 시료마다는 1cm 정도 거리를 두고 점적한다. 점적한 점의 크기는 작으면 작을 수록 좋아서 직경이 5mm 이하면 정량분석을 할 수 있다. TLC 판에 점적을 한 후에는 용매가 들어 있는 TLC chamber에 넣고 올리게 되는데, 용매가 올라가는 원리는 모세관 현상이다. TLC 판 위에서 1cm 정도 가량까지 용매가 올라가면 TLC판을 꺼내고 용매를 말린다. 보통의 화합물이 무색이라 확인하기 위해서는 Iodine이 있는 통에 넣거나, fluorescence를 띄면 UV를 쬐서 확인하거나, 황산에 담구었다가 가열하여 태우는 방법 등을 사용한다. 그리고 TLC에서는 Rf 라는 값을 사용하는데, retention factor로 물질과 용매에 따라 달라지는 값이다. 하지만 모든 상황이 같다면 같은 물질에 대해서는 Rf값이 일정하며, Rf는 Rf = 시료의 전개거리 / 용매의 전개거리로 정의한다.
drying agent, 즉 desiccant는 물을 흡수하는 것으로 보통 실리카겔, 황산칼슘(CaSO4), 염화칼슘(CaCl2), Montmorillonite 등이 있다.
그리고 또 다른 분리방법으로는 Recrystallization(재결정)이 있다. 재결정은 화합물을 정제하는 방법중 하나로써, 우리가 얻고자 하는 화합물 A와 그 화합물 A를 오염시키는 적은 양의 불순물 B가 있다고 하자. recrystallization에는 여러가지가 있는데, Single-solvent, Multi-solvent, Hot-filtration recrystallization 등이 있다. 그중 Single-solvent recrystallization을 할 때 보통 혼합물을 넣기 전에 용매를 따뜻하게 해서 용해도를 높인다. 그리고 혼합물을 넣고 온도를 서서히 낮춘다. 그러면 용액이 식으면서 화합물의 용해도가 떨어지게 된다. 그 결과로 우리가 원하는 화합물 A가 용액으로부터 석출(재결정)된다. 식히는 속도를 천천히 하면 할 수록 점점 더 큰 결정이 형성된다. 일단 용액에서 작은 결정이 형성되면, 그 결정이 점점 자라게 되어 결정이 커지게 된다. 그래서 화합물 A가 용액 안에 포화상태를 넘게 되어 먼저 결정을 형성하고, 불순물은 그대로 용액안에 남게 된다. 이 결과로 얻은 고체는 원래의 혼합물보다 더 순수하다. 순도의 확인은 재결정하여 얻은 고체의 녹는점과 재결정하기 전의 고체의 녹는점을 비교하는 것이다. 순도가 높은 것은 더 낮은 녹는점과 녹는 범위가 좁다. 그리고 효과적인 재결정은 정확한 용매를 찾는 것에 달려있다. 보통 조합을 prediction/experiment 나 trial/error 를 사용하여 찾는다. 그리고 선택한 용매는 높은 온도에서 혼합물을 녹여야만 하고, 낮은 온도에서 우리가 원하는 물질이 녹지 않아야만 한다.
용액에서 염이 용해도에 영향을 주는데, 그 중 하나가 common-ion effect(공통이온효과) 이다. 공통이온효과는 두개의 용질이 공통된 이온을 가지고 있을 때 나타난다. 그리고 공통이온효과는 약산이나 약염기의 이온화를 더 못하게 만들 수 있다. 그 이유는 평형에서의 르샤틀리에의 원리에 의하여 이온이 많아지면 역반응으로 이온화가 되지 않은 것이 많아지기 때문이다.
그리고 또다른 효과는 Salting out(염석 효과)이다. 염석효과는 원래 고농도의 염속에서 단백질이 덜 녹는다는 것을 이용해 분리하는 방법이다. 어떤 한 물질이 소수성인 부분과 친수성인 부분이 공존할 때, 물에 녹는다는 것은 친수성인 부분이 물과의 인력이 작용하여 수화가 된다는 것이다. 그런데 염의 농도가 높아지면 물분자가 염 이온과의 인력이 강해지고 그만큼 녹아있던 물질과의 인력이 약해진다. 그 결과 용질끼리의 인력이 용질과 물의 인력보다 강해지면서 석출되게 된다. 이러한 과정을 염석 효과라고 한다. 하지만 어떤 이온은 농도가 높아지면 물질의 용해도가 증가할 수 있어서 주의해야한다. 어떤 물질을 물로부터 제거할 때 NaCl이 사용되는데, NaCl이 물과의 인력이 작용하여서 전체적으로 극성이 강해진다. 따라서 물질들은 유기용매쪽으로 옮겨가 추출된다.
또 물질을 분리하는 방법 중에는 chromatography가 있는데, 그중에서도 TLC를 자주 사용한다. TLC는 thin layer chromatography로, 주로 유리, 플라스틱, 알루미늄 호일 위에 코팅된 실리카겔이나 알루미나, 셀룰로오스 등이 사용된다. TLC는 주로 반응의 진행을 볼 때, 화합물이 뭔지 알아낼 때, 물질의 순도를 확인할 때 사용한다. TLC를 할 때 용매에 닿는 부분으로부터 1.5cm 위에 시료를 점적하는데, 각 시료마다는 1cm 정도 거리를 두고 점적한다. 점적한 점의 크기는 작으면 작을 수록 좋아서 직경이 5mm 이하면 정량분석을 할 수 있다. TLC 판에 점적을 한 후에는 용매가 들어 있는 TLC chamber에 넣고 올리게 되는데, 용매가 올라가는 원리는 모세관 현상이다. TLC 판 위에서 1cm 정도 가량까지 용매가 올라가면 TLC판을 꺼내고 용매를 말린다. 보통의 화합물이 무색이라 확인하기 위해서는 Iodine이 있는 통에 넣거나, fluorescence를 띄면 UV를 쬐서 확인하거나, 황산에 담구었다가 가열하여 태우는 방법 등을 사용한다. 그리고 TLC에서는 Rf 라는 값을 사용하는데, retention factor로 물질과 용매에 따라 달라지는 값이다. 하지만 모든 상황이 같다면 같은 물질에 대해서는 Rf값이 일정하며, Rf는 Rf = 시료의 전개거리 / 용매의 전개거리로 정의한다.
drying agent, 즉 desiccant는 물을 흡수하는 것으로 보통 실리카겔, 황산칼슘(CaSO4), 염화칼슘(CaCl2), Montmorillonite 등이 있다.
'Organic Chemistry > Organic Chemistry Exp.' 카테고리의 다른 글
| Grignard Reaction (그리나르 반응) (4) | 2010.12.15 |
|---|---|
| Electrophilic Aromatic Substitiution (친전자성 방향족 치환 반응) (3) | 2010.12.14 |
| Distillation & Purification (0) | 2010.09.14 |

