상 전이, Phase transition은 열학계의 변화로 열 공급을 통해 한 가지 상phase에서 다른 상으로 변하는 것을 말한다. 이 단어는 물질의 고체solid, 액체liquid, 기체gas 간의 전이를 표현할 때 자주 사용된다. 열역학 계의 상과 물질의 상태는 각각 일정한 물리적인 성질을 가진다. 상 전이가 일어나는 동안에 물질의 몇몇 성질들은 변하며, 종종 불연속적으로도 변한다. 온도나 압력 또는 다른 외부 성질들이 변함으로써 상전이가 일어난다. 그 에로 액체를 끓는점으로 가열하게 되면 기체로 변하게 되며, 그 결과로 부피는 급격하게 변한다.
화학 퍼텐셜, Chemical Potential
상평형 그림을 열역학적으로 설명하기 위해서는 물질의 깁스 자유 에너지,Gibbs free energy로 설명한다. 이 중에서도 몰 Gibbs 에너지 Gm가 중요하며 화학 퍼텐셜,Chemical potential이라 부르며 μ라고 표현한다. 단일 성분으로 이루어진 계에서는 몰 Gibbs 에너지와 화학 퍼텐셜은 같은 뜻을 가지며 μ=Gm 이다.
평형의 열역학적 기준
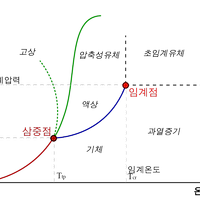
평형equilibrium 상태에서는 한 물질의 상의 수와 상관 없이 시료 전체의 화학 퍼텐셜은 같다. 오른쪽 그림의 기체와 액체가 평형 상태에 있다면 어느 지점에서나 이 물질의 화학 퍼텐셜은 같다.
어떤 물질의 화학 퍼텐셜이 한 위치에서 μ1이고 다른 곳에서 μ2이며 dn 만큼의 물질이 첫번째 위치에서 두번째 위치로 이동한 경우 이를 식으로 나타내면,
이고
(1)
따라서 전체 변화량은
(2)
이때 μ1>μ2 이면 dG<0 이 되어 물질의 이동, 즉 상전이가 자발적으로 일어나게 된다. 한편 μ1=μ2이면 dG=0이 되므로 이러한 경우에만 계들이 평형을 이루게 된다.
상의 안정도의 의존성
1) 상의 안정도의 온도 의존
Gibbs 자유 에너지의 온도 의존도는 계의 엔트로피로 나타낼 수 있다. 순수한 물질의 화학 퍼텐셜은 물질의 몰 Gibbs 에너지와 같으므로 아래처럼 쓸 수 있다.
(3)
식(3)에 의하면 온도가 올라감에 따라 순수한 물질의 화학 퍼텐셜은 감소한다. 즉 모든 물질에 대해서 Sm>0 이므로 μ의 T에 대한 그래프는 음의 기울기를 가진다. 각 물질의 엔트로피는 Sm(s) < Sm(l) < Sm(g)순이다. μ(l)의 기울기는 μ(s)에 비해 더 큰 음의 기울기를 갖고 있어서 온도가 어느정도 올라가면 μ(l)가 μ(s)보다 작아진다. 이 작아지는 순간의 온도가 녹는점melting point이 되며 고체가 안정한 상에서 액체가 안정한 상으로 상 전이가 일어난다.
2) 녹는점의 압력 의존
Gibbs 자유 에너지의 온도 의존도는 계의 몰부피로 나타낼 수 있다. 즉 아래 식처럼 쓸 수 있다.
(4)
식(4)로부터 알 수 있듯이 화학 퍼텐셜에 대한 압력의 효과는 몰부피(Vm>0)에 해당하므로 압력을 높이면 화학 퍼텐셜이 증가한다. 또한 대부분의 물질들에 대한 몰 부피는 Vm(s) < Vm(l) 의 순서를 가지므로 압력늘 높이면 물을 제외하고 액체의 화학 퍼텐셜이 고체보다 크게 증가하게 된다.
3) 증기압의 압력 의존
녹는점의 압력 의존과는 달리 '응축상에만 압력을 가하는 경우의 증기압 변화'에 대한 논의이다. 증기상과 응축상에 동시에 압력을 증가시키면 기체의 몰부피가 응축상의 몰부피보다 월등히 커서 식(4)에 의해 기체상의 화학 퍼텐셜이 응축상보다 매우 크게 증가하여 상전이는 기체에서 응축상으로 일어나게 된다.
응축상에만 여분의 압력 ΔP를 가할 때 증기압이 변하는 것을 알아보자.
평형 상태에서는 두 가지 상의 화학 퍼텐셜이 같으므로, 액체상과 기체상이 평형상태에 있다면
μ(l)=μ(g)
(5)
평형 상태를 깨뜨리지 않는 변화에 대하여는 어느 경우에나 두 가지 상의 화학 퍼텐셜의 변화량이 같아야한다.
dμ(l)=dμ(g)
(6)
액체상에 작용하는 압력이 dP만큼 변화하는 경우의 액체상의 화학 퍼텐셜 변화량은 다음과 같다. (액체상의 압력은 대문자 P를 사용하겠다.)
dμ(l)=dVm(l)dP
(7)
기체상에 작용하는 압력이 dp만큼 변화하는 경우(기체상의 압력은 소문자p를 사용하겠다.), 증기상의 화학 퍼텐셜 변화량을 식(8)과 같이 쓴다면, 이때의 변화량 dp가 구하고자하는 증기 압력의 변화량이다. 또 액체에만 압력을 가하므로 p≠P 이다.
dμ(g)=dVm(g)dp
(8)
기체상의 증기를 완전기체로 가정하면 Vm(g)=RT/p가 되므로
(9)
변화 후에 두 가지상이 평형 상태에 있다면 식(6)과 식(7)에 의해 아래와 같이 쓸 수 있다.
(10)
여분의 압력이 액체상에 작용하지 않을 때 액체 상에 작용하는 압력 P는 정상적인 증기압 p*(p*는 순수한 물질의 증기압)와 같으므로 P=p*이고 따라서 증기압 p=p* 이다. 다음으로 액체상에 여분의 압력 ΔP가 작용하여 P=p*+ΔP 가 되는 경우의 증기 압력이 구하고자하는 p가 된다. 따라서 이를 구간으로 삼고 적분을 하면,
(11)
식(11)의 적분을 하면,
(12)
로그를 지수로 바꾸면 식(13) 된다.
(13)
'Physical Chemistry > Thermodynamics' 카테고리의 다른 글
| 상 경계의 위치, Phase boundary (1) | 2014.11.12 |
|---|---|
| 순수한 물질의 상 (0) | 2014.08.12 |
| Gibbs 에너지의 성질 (1) | 2014.08.09 |
| 1법칙과 2법칙의 결합, Combining the First and Second Laws (0) | 2014.08.08 |
| 자발성에 대한 기준, Criteria for Spontaneity (4) | 2014.05.03 |