친핵성 치환(Nucleophilic substitution)에 대한 일반적인 특성은 이미 다루었다. 이 글에서는 메카니즘을 다루기로 한다. 먼저 친핵성 치환의 전체 반응식은 다음과 같다.
이러한 친핵성 치환 반응에서는 R-X의 σ결합이 끊어지고, R-Nu의 새로운 σ결합이 생겨난다. 그렇다면 결합이 끊어지고 생성되는 순서에 어떤 가능성이 있는지 알아보자.
1. 결합이 끊어지고 생성되는 과정이 동시에 일어난다.

C-X 결합이 끊어지는 것과 C-Nu결합이 생성되는 것이 동시에 일어난다면 메카니즘은 한 단계이며, 반응속도론에서 이 반응의 반응 속도식은 다음과 같을 것이다.
반응 속도 = k[RX][:Nu-]
이 반응은 두 반응물의 농도에 의존하며, 반응식은 이차가 된다.
2. 결합이 먼저 끊어지고 나중에 새로운 결합이 형성된다.

C-X 결합이 먼저 끊어지고 탄소양이온(carbocation)이 형성된다. 탄소양이온에 :Nu-가 공격하여 새로운 C-Nu 결합이 형성된다. 이렇게 메카니즘은 두 단계로 일어난다. C-X가 끊어지는 첫 단계가 속도 결정 단계(rate-determinig step)이므로 반응 속도식은 다음과 같다.
반응속도 = k[RX]
반응속도가 RX의 농도에만 의존하기 때문에 반응속도식은 일차이다.
3. 결합이 먼저 생성되고 나중에 결합이 끊어진다.

C-Nu 결합이 먼저 생성되고 나중에 C-X결합이 끊어진다면 메카니즘은 두단계이다. 하지만 이러한 메카니즘의 문제점은 첫 단계에서 생성된 중간체(intermediate)는 열개의 전자를 가진 탄소가 나타나게 된다. 탄소가 10개의 전자를 가지게 됨으로써 팔전자 규칙(octet rule)에 어긋나게 된다. 따라서 이러한 메카니즘으로 반응은 일어나지 않는다.
SN2 반응의 한 예로 CH3Br (Bromomethane)과 CH3COO- (actate)의 반응이 있다. 전체적인 반응식은 다음과 같다.

○ 반응속도론 (Kinetics)
SN2 반응은 이차 속도식(second-order kinetics)으로 표현된다. 이분자 반응(bimolecular)이며, 속도식에는 할로젠화 알킬(Alkyl halide)와 친핵체(Nucleophile) 모두 나타난다.
반응 속도 = k[CH3Br][CH3COO-]
두 반응물 모두 속도에 영향을 주기 때문에, bromomethane의 농도를 2배로 증가시키면 반응 속도가 2배가 된다. 그리고 두 반응물 모두 농도를 2배로 증가시키면 반응 속도는 4배가 된다.
○ 한 단계 메카니즘 (A One-step Mechanism)
| SN2 반응은 결합이 끊어지는 것과 생성되는 것이 동시에 일어난다. |
 |
위 과정을 플래시로 보면 다음과 같다.

[ 수산화 이온과 Chloromethane의 반응, 흰색은 H, 빨간색은 O, 하늘색은 C, 연두색은 Cl 이다.]
○ 입체화학 (Stereochemistry)
SN2 반응에서 친핵체는 과연 어느쪽에서 접근할까? 생각할 수 있는 가능성은 이탈기 앞쪽으로 공격(frontside attack)하는 것과 이탈기의 뒤쪽에서 공격(backside attack)하는 것, 두가지가 있을 수 있다.
그렇다면 CH3CH(D)Br 과 친핵체 :Nu-의 반응을 가지고 살펴보자.
먼저 친핵체가 아래의 그림과 같이 이탈기의 앞쪽에서 공격한다고 보자.

그렇다면 입체 중심(stereogenic center) 탄소에 대해 배열은 보존(retention of configuration)된다.
이어서, 친핵체가 뒤쪽에서 공격한다고 보자.

이탈기의 반대편에서 접근하여 친핵체가 공격을 하면, 입체 중심(stereogenic center) 탄소에 대해서 배열은 반전(inversion of configuration)된다.
이렇게 두가지 가능성이 있는데, 앞쪽 공격의 생성물과 뒤쪽 공격의 생성물은 서로 다른 화합물이다. 두 화합물은 입체이성질체(stereoisomer)이며, 정확하게는 거울상이성질체(enantiomer)이다. 거울상이성질체는 서로 겹쳐지지 않는다.

이렇게 두가지의 생성물이 생겨날 가능성이 있지만, SN2 반응에서는 뒤쪽 공격 생성물만이 생성된다.
모든 SN2 반응은 친핵체가 뒤쪽에서 공격하고, 입체 중심에서 배열의 반전이 일어난다.
1896년 라트비아 화학자 Paul Walden 박사가 처음으로 관찰하였기 때문에 SN2 반응에서 일어나는 반전을 Walden 반전(Walden inversion)이라고도 부른다.
즉 반응의 전체 메카니즘은 다음과 같이 생각할 수 있다.

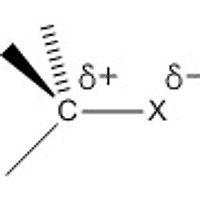
친핵체와 이탈기는 모두 전자가 풍부하다. 그리고 같은 전하끼리는 서로를 밀어내는 척력이 있다. 그러면 척력을 최소화하면서 공격하는 방법은, 뒤쪽에서 공격하는 방법뿐이다. 전이상태(transition state)에서 친핵체와 이탈기는 서로 180˚ 방향으로 멀리 떨어져있고, 다른 세개의 원자단(H, D, R)은 탄소와 함께 한 평면상에 있다.
다른 SN2 반응에서도 역시 배열의 반전이 일어난다.

○ R기의 수에 따른 반응이 변화
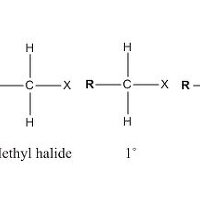
할로젠화 알킬(alkyl halide)에서 메틸, 1˚, 2˚, 3˚으로 붙어있는 알킬기의 수가 증가하면 SN2 반응의 속도는 감소한다.

결론부터 말하자면, 메틸과 1˚ alkyl halide는 SN2 반응을 잘하고, 2˚ alkyl halide는 SN2 반응이 느리고, 3˚ alkyl halide는 반응을 하지 않는다. 그 이유는 입체 효과로 설명할 수 있다. SN2반응은 backside attack이다. 그런데, halomethane이나 1˚ alkyl halide 에서는 이탈기 X의 뒤쪽은 작은 수소원자가 있어서 nucleophile이 접근하기가 쉬운 반면에, 3˚ alkyl halide는 수소에 비해 부피가 매우 큰 알킬기가 일으키는 입체 장애 (steric hinderance)로 인해 뒤쪽에서 공격하기가 어려워진다. 따라서 알킬기의 숫자가 늘 수록 반응속도는 느려지게 된다. SN2반응은 입체 장애를 받지 않는 alkyl halide가 반응속도가 빠르다.

[bromomethane, bromoethane, 2-bromopropane, t-butyl bromide]
위 그림에서 알킬기의 수가 늘어날 수록 브롬 원자의 뒤쪽이 더더욱 가려지는 것을 볼 수 있다.
○ SN2반응의 예
SN2 반응은 결핵에 효과가 있는 ethambutol(에탐뷰톨, 상품명 : Myambutol)이나 항우울제인 fluoxetine(플루옥세틴, 상품명 : Prozac)의 합성에 쓰인다.

[결핵 치료제인 ethambutol의 합성]

[항우울제인 fluoxetine]
그리고 우리몸에는 S-adenosylmethionine(SAM)이 있는데, 부신(adrenal gland)에서 노르아드레날린(noradrenaline, 노르에피네피린, norepinephrin)과의 SN2 반응을 통해 아드레날린(adrenaline, 에피네피린, epinephrin)합성이 일어나는 과정 중 하나이기도 하다. 아래의 구조가 바로 SAM이다.

그리고 노르아드레날린과 SAM의 반응은 다음과 같이 진행된다.

'Organic Chemistry' 카테고리의 다른 글
| E2 Reaction (6) | 2011.08.20 |
|---|---|
| Unimolecular Nucleophilic Substitution, 일분자 친핵성 치환 반응 (3) | 2011.07.28 |
| Nucleophilic Substitution (친핵성 치환) (2) | 2010.11.29 |
| Alkyl Halide (할로젠화 알킬) (1) | 2010.11.22 |
| Conformations of Acyclic Alkanes, Newmann projection (0) | 2010.09.25 |