|
탄소, Carbon | |
|
원자 기호 |
C |
|
원자 번호 |
6 |
|
족, 주기, 구역 |
14족, 2주기, p-구역 |
|
전자배치 |
1s2 2s22p2 |
 | |
|
탄소의 스펙트럼  | |
|
원소 분류 |
비금속 |
|
원자량 |
12.0107(8) |
|
상태 |
고체 |
|
밀도 |
비결정성 : 1.8~21 g·cm−3 흑연 : 2.267 g·cm−3 다이아몬드 : 3.515 g·cm−3 |
|
승화점 |
3915 K, 3642 °C |
|
삼중점 |
4600 K (4327°C), 10800kPa |
|
융해열 |
117 kJ/mol (흑연) |
|
열용량 |
8.517(흑연) J·mol−1·K−1, 6.155(다이아몬드) J·mol−1·K−1 |
|
산화수 |
4, 3, 2, 1, 0, -1, -2, -3, -4 |
|
전기음성도 |
2.55 (폴링 척도) |
|
이온화에너지 |
1st: 1086.5 kJ·mol−1
2nd: 2352.6 kJ·mol−1
3rd: 4620.5 kJ·mol−1 |
|
공유 반지름 |
77 pm (sp³) 73 pm (sp²) 69 pm (sp) |
|
반데르발스 지름 |
170 pm |
|
자기성 |
반자성 |
|
열전도율 |
119-165 (흑연) W·m−1·K−1 900-2300 (다이아몬드) W·m−1·K−1 |
|
음속 |
(20 °C) 18350 (다이아몬드) m·s−1 |
|
열팽창계수 |
(25 °C) 0.8 (다이아몬드) µm·m−1·K−1 |
|
모스굳기 |
1~2 (흑연) 10 (다이아몬드) |
탄소Carbon은 원자 번호 6, 원소 기호 C를 가지는 원소이다. 주기율표에서 14족에 속해있고, 비금속이고 4배위수를 가졌다. 자연적으로 발견되는 동위원소는 세가지가 있는데, 12C 와 13C는 안정하고, 14C는 방사성이 있고 반감기는 5,730년이다. 탄소는 18세기 이전부터 원소라고 알려진 몇가지 안되는 원소중 하나다. 이전에 알려진 원소는 총 34가지로, H, Be, C, N, O, Mg, P, S, Cl, Ti, Cr, Mn, Fe, Co, Zn, As, Sr, Y, Zr, Mo, Ag, Sn, Sb, Te, Ba, W, Pt, Au, Hg, Pb, Bi, U 이 전부이다.
탄소의 동소체는 여러가지가 알려졌는데, 그중 많이 알려진 것은 흑연, 다이아몬드, 그리고 비결정성 탄소이다. 탄소의 물리적인 성질은 동소체의 형태마다 매우 다르다. 그 예로, 다이아몬드는 투명하지만, 흑연은 불투명하고 검다. 다이아몬드는 가장 단단한 물질이라고 알려졌지만 흑연은 종이가 분말로 만들 수 있을 정도로 부드럽다(그리고 흑연이라는 이름은 그리스어 '쓰다'에서 왔다). 다이아몬드는 매우 낮은 전기전도도를 가졌지만, 흑연은 매우 좋은 전도체이다. 표준 상태에서는 다이아몬드는 알려진 모든 물질 가운데 가장 높은 열전도율을 가진다.
모든 탄소의 동소체는 표준상태에서 고체이다. 동소체들은 화학적으로 저항성이 있고, 산소와 반응하기 위해서는 높은 온도를 필요로 한다. 가장 많이 알려진 무기화합물에서 탄소의 산화수는 +4이고, +2는 일산화탄소(CO)와 전이금속 카보닐 화합물에서 발견된다. 무기물 탄소의 가장 큰 원천은 석회석(limestone), 백운암(dolomite) 그리고 이산화탄소이다. 탄소는 다른 원소들과도 많은 화합물을 이루는데, 지금까지 알려진 순수 유기화합물만 천만개에 이른다.
탄소는 지구 지각에 15번째로 많은 원소이고, 우주에서 질량으로 따졌을때 수소, 헬륨, 산소 다음으로 네번쨰로 많은 원소이다. 지금까지 알려진 모든 생물체, 그리고 인간의 몸에서 탄소는 질량으로 따졌을 때 산소 다음으로 많은 원소(약 18.5%)이다. 탄소의 풍부함과 유기화합물의 독특한 다양성이 만나 지구 온도에서 다양한 고분자를 형성하고, 알려진 모든 생명체의 기본이 되는 원소가 되었다.
성질

이론적으로 예측한 탄소의 상평형도
탄소의 동소체 중에서 자연적으로 존재하는 모든 물질중에서 가장 단단한 다이아몬드, 알려준 물질 중에서 가장 부드러운 흑연이 있다. 게다가 탄소는 탄소 원자를 포함하는 작은 원자들과 결합하는 친화력이 있고, 이런 원자들과 여러개의 안정한 공유결합을 형성한다. 그 결과로 탄소는 천만개의 다른 화합물이 알려져있다. 탄소는 모든 원소들 중에서 가장 높은 승화점을 가졌다. 삼중점이 10.8 ± 0.2 MPa, 4,600 ± 300 K(4.330 ℃)에 있기에 대기압하에서는 녹는점을 가지지 않고, 3,900K에서 승화하게 된다.
약 5,800K(5,530℃)의 온도를 가지는 탄소 아크carbon arc에서 탄소의 승화가 일어난다. 탄소의 모든 동소체 형태에 상관없이 탄소는 가장 높은 녹는점을 가지는 텅스텐이나 레늄과 같은 금속보다도 높은 온도에서 고체로 존재한다.비록 열역학적으로 산화되는 경향이 있지만, 탄소는 실온에서 약한 환원제인 철이나 구리와 같은 원소보다 효과적으로 산화에 저항성이 있다.
탄소 화합물은 알려진 지구의 모든 생명체의 기본이 되고 탄소-질소 순환은 태양과 다른 항성들이 생산해낸 에너지를 제공한다. 비록 탄소 화합물들은 매우 다양한 화합물을 형성하지만, 대부분의 탄소 화합물들은 표준상태에서 반응성이 상대적으로 없다. 표준 온도와 압력에서, 가장 강력한 산화제를 제외한 모든 것에 저항성이 있다. 탄소화합물은 황산, 염산, 염소나 다른 알칼리와도 반응을 하지 않는다. 높은 온도에서 탄소는 산소와 반응하여 산화탄소를 형성하고, 철산화물과 같은 금속 산화물을 환원시켜 금속으로 만든다. 이 발열반응은 철강의 탄소함유량을 제어하기 위해 철강 산업에서 사용된다.
높은 온도에서 금속에 탄소를 섞으면 금속 탄화물metallic carbide을 형성하는데, 텅스텐 카바이드는 절삭 도구의 단단한 부분을 만드는데 사용한다.
2009년에 그래핀graphene은 가장 강한 재료로 보여진다. 하지만, 산업에서 사용할 정도로 경제적이 되려면 흑연으로부터 분리해내는 과정이 기술적으로 개발이 되어야한다.
동소체allotrope
탄소 원자 자체는 불안정한 화학종이기 때문에 다양한 다원자구조로 안정화 되고, 같은 원자로 이루어진 분자의 다른 배치를 동소체allotrope라고 한다. 탄소의 동소체 중에서 상대적으로 잘 알려진 것은 세 개가 있는데, 비결정성 탄소와 흑연, 다이아몬드가 그것이다. 이들을 제외하더라도, 버키볼buckyball, 탄소 나노튜브carbon nanotube, carbon nanobud이나 나노섬유nanofiber등을 포함하는 풀러렌fullerene은 요즘 자주 합성되고 연구에 사용된다. 이외에도 론스데일라이트lonsdaleite, 유리상탄소glassy carbon, carbon nanofoam, linear acetylenic carbon(LAC, carbyne) 등도 발견되어 연구되고 있다.
비결정성 탄소는 무결정성, 비규칙적, 유리상등과 같이 근본적으로 흑연과 같은 구조지만 거시적으로는 결정이 아닌 탄소 원자의 배열을 말한다. 가루 상태로 존재하는 목탄(차콜)charcoal, 유연lampblack(그을음soot), 활성탄activated carbon등이 있다. 대기압에서 탄소는 흑연 상태로 존재하는데, 흑연에서 각 탄소 원자는 평면 삼각형으로 존재하면서 전체적으로는 육각형 고리 구조인데 방향족 탄화수소와 같이 생겼다. 결과적으로 그물망은 2차원적이고 각 판들은 약한 van der Waals 힘에 의해 느슨하게 붙어있다. 이런 약한 결합은 흑연이 무르고 잘 부스러지는 성질을 갖게 한다. 흑연에서는 외각 전자들이 delocalization 된 pi-cloud를 이루는데, 이는 흑연이 전기전도성을 갖게 해준다.
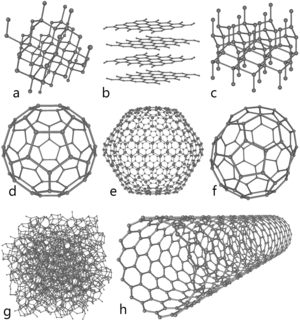
탄소의 동소체의 분자 구조
a)다이아몬드, b)흑연, c)론스데일라이트
d)풀러렌 C60 , e)풀러렌C540, f)풀러렌C70
g)비결정성 탄소, h)탄소 나노튜브
풀러렌Fullerene은 흑연과 비슷한 구조를 가지지만, 완벽한 육각형 구조가 아니라, 오각형 또는 칠각형으로 이루어진 탄소 원자를 가지고, 구, 타원 또는 실린더 모양이 되기 위해서 휘어져있다. 풀러렌의 성질은 아직 완벽하게 분석되지 않았고, 나노물질 영역에서 연구되고 있다. 풀러렌과 버키볼의 모양과 비슷한 지오데식 돔을 상업화시킨 Richard Buckminster Fuller의 이름을 따와 fullerene과 buckyball의 이름을 지었다. 버키볼은 탄소가 삼각형으로 결합된 형태의 매우 큰 분자인데, 구처럼 생겨서 spheroid라고 한다. 가장 잘 알려져있고 가장 간단한 것은 축구공 모양의 C60 벅민스터풀러렌buckminsterfullerene 이다. 탄소 나노튜브는 구조적으로 버키볼과 비슷하지만 각 원자는 삼각형으로 결합되고 휘어져 있어서 속이 빈 실린더를 형성한다. Nanobuds는 2007년에 처음 발표되었는데 bucky tube와 buckyball materials의 하이브리드다.
다른 동소체 중 하나는 carbon nanofoam으로 1997년에 발견된 강자성의 동소체이다.
존재량
산소와 결합을 하면 이산화탄소가 되는데, 지구 대기에서 탄소는 이산화탄소 형태로 약 810Gton(기가톤) 존재한다. 그리고 바다에도 약 36,000Gton이 녹아있다. 그리고 1,900Gton의 탄소는 생물계에 존재한다. 석탄, 석유와 천연가스등의 탄화수소에 포함된 탄소는 약 900Gton이 있고, 남은 원유는 150Gton이 있다. 천연 가스는 약 175×1012 m3 있다고 생각되는데 약 105Gton의 탄소이다. 그런데 암석에 갇힌 가스인 셰일 가스shale gas는 비경제적인 가스인데 약 900
×1012 m3 있다고 생각되는데, 이는 탄소 약 540Gton에 해당하는 양이다. 과거에는 탄화수소의 양은 많았는데, 1751년부터 2008년 사이의 기간 동안 347Gton의 탄소가 화석을 태워서 발생하는 이산화탄소로 대기중으로 방출되었다. 탄소는 메탄(메테인, methane)과 불타는 얼음인 methane hydrate은 극지방에 있다. 이들 양은 약 1,400Gton이 있다고 생각되는데 시베리아 대륙봉의 영구동토 아래에 있다.
탄소는 매우 많이 존재하는 석회석, 백운암, 대리석등과 같이 탄산염 암석의 주 성분이다. 석탄은 가장 큰 미네랄 탄소의 원천인데, 화석 탄소 연료의 80%인 4,000Gton이 있다. 그리고 무연탄anthracite은 92~98%가 탄소로 되어있다.
흑연은 미국의 뉴욕이나 텍사스, 러시아, 맥시코, 그린란드, 인도에서 많은 양이 발견된다. 천연 다이아몬드는 킴벌라이트kimberlite 암석 속에 존재한다. 대부분의 다이아몬드는 남아프리카, 나미비아, 보츠와나, 콩고 공화국, 시에라리온에 존재한다. 그리고 미국의 아칸소주와 캐나다, 러시아의 북극지방, 브라질과 호주의 북쪽과 서쪽 지방에서도 존재한다. 다이아몬드는 희망봉의 대양저에서도 발견되었다. 하지만, 다이아몬드는 자연적으로는 원석으로 존재해서, 산업적인 다이아몬드는 미국에서 합성하고 약 30%를 차지한다.
탄소-14는 대류권위와 성층권 아래인 고도 9~15km에서 형성되는데, 우주선이 관여되는 핵반응을 통해 생성된다. 열중성자Thermal neutron가 질소-14의 핵과 충돌해 탄소-14와 양성자 한개를 만든다.
동위원소
탄소의 동위원소에서 원자 핵은 6개의 양성자와 2개에서 16개의 중성자로 이루어진다. 탄소는 두개의 안정하고 자연에서 발견되는 동위원소를 가진다. 탄소-12(12C)는 지구에 존재하는 탄소 중에서 98.93%를 차지하고, 탄소-13(13C)은 1.07%만을 차지한다. 생체 물질에서는 12C의 비율이 더욱 높아지는데, 생화학 반응이 13C을 제외하는 쪽으로 일어나기 때문이다. 1961년 IUPAC(International Union of Pure and Applied Chemistry, 국제 순수 응용 화학 연합)은 12C를 원자 질량의 기본으로 정했다. NMR 실험에서 탄소의 측정은 13C을 측정하는 것이다.
방사성 동위원소인 탄소-14(14C)는 1ppt(1 part per trillion, 0.0000000001%)만큼 존재한다. 이 동위원소는 0.158 MeV
β- emission을 하여 붕괴한다. 반감기가 5730년이기 때문에, 고대 암석에서는 존재하지 않는다. 탄소-14는 대류권과 성층권 사이에서 생성되고 대기에는 일정한 농도의 14C가 존재한다. 그래서 살아있는 생명체 내에도 일정한 농도의 14C가 존재하게 되는데, 숨을 더이상 쉬지 않고 죽게되면 14C의 농도는 내려가게 된다. 14C의 농도가 줄어들은 정도를 알아내는 탄소연대측정이 1949년 개발되었다.
탄소의 동위원소는 15개가 알려져있는데 그 중 가장 짧은 반감기인 1.98739x10−21 s를 가지고 양성자 방출과 알파 붕괴를 하는 것은 8C 이다. 19C는 nuclear halo로 알려져있다.
항성에서의 형성
탄소 원자 핵의 형성은 헬륨 핵인 알파 입자 세개가 동시에 충돌을 해야한다. 이런 과정은 거성 또는 초고성 항성의 핵에서 일어나는데 triple-alpha process라고 알려져 있다. 헬륨과 수소의 핵 융합 반응의 생성물로 Li-5, Be-8이 생기고 두 핵 모두 매우 불안정해서 더 작은 핵으로 붕괴되버린다. 이런 반응이 일어니기 위해서는 100MK(megakelvin) 이상의 온도 조건과 일정 농도 이상의 헬륨이 필요하지만 우주가 급속히 팽창함과 동시에 냉각이 되어서 탄소는 빅뱅 중에 생성되지 못했다. 그 대신에 항성의 내부에서 세개의 헬륨 핵이 탄소로 되는 triple-alpha process가 일어난다. 우리가 알다시피 생명이 탄생을 하기 위해서는 탄소는 초신성 폭발과 같이 우주 속으로 먼지로 흩어질 필요가 있고, 그 후에 생겨나는 두번째, 세번째 항성계에서 우주 먼지로부터 행성이 모아야한다. 태양계는 세번째 세대 항성계에 속한다. 또 다른 항성에서 일어나는 핵융합 과정으로는 CNO cycle이 있는데, 이 과정에서 탄소는 촉매로 작용을 한다.
일산화 탄소의 동위원소들의 회전 전이(12CO, 13CO, 18CO)는 submillimeter 파장 범위에서 검출이 가능하고, 새로 태어난 항성이나 우주 구름들을 연구할 때 사용한다.
탄소 순환carbon cycle
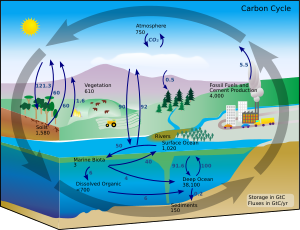
탄소 순환의 모식도. 검은 숫자는 각 위치에 얼마나 저장되었는지 나타내는 숫자이다.
(각 숫자는 GtC 단위이다. GtC는 탄소 1Giga ton을 나타낸다.)
보라색 숫자는 각 위치에서 움직이는 숫자이다.
지상에서 하나의 원소가 다른 원소로 전환이 되는 일은 매우 희박하다. 그래서 지구에 있는 탄소의 양은 일정하다. 따라서, 탄소를 사용하는 과정은 어떤 곳에서 오고, 다른 곳으로 가게 된다. 환경에서 탄소는 순환을 하게 된다. 그 예로 식물은 이산화탄소를 주위로부터 흡수해 자신의 영양분으로 만들고, Calvin cycle을 통해 고정된다. 식물이 만든 영양분은 동물들에 의해 먹히기도 해서, 다시 이산화탄소가 되어 배출된다. 어떤 이산화탄소는 바다에 녹기도 하고, 죽은 식물이나 동물은 후에 석유나 석탄이 될 수도 있다.
유기화합물
탄소는 C-C 결합을 통해 매우 긴 사슬을 만들 수 있다. 이러한 성질을 카테네화catenation라고 한다. 탄소-탄소 결합은 강하고, 안정하다. 이런 성질은 탄소가 무한에 가까운 갯수의 화합물을 만들게 한다. 사실, 탄소를 함유하는 화합물은 수소를 제외한 다른 원소들이 만들 수 있는 화합물보다도 더 많다. (수소를 제외하는 이유는 대부분의 유기화합물이 수소도 포함하기 때문이다.)
가장 간단한 형태의 유기화합물은 탄화수소이다. 유기 분자의 가장 많은 형태중 하나로 탄소 원자 사슬에 수소가 결합되어 있는 형태이다. 사슬의 길이와 곁가지, 그리고 작용기는 모두 유기 분자의 성질에 영향을 준다. IUPAC의 정의에 의하면 모든 유기 화합물은 탄화수소 화합물에 작용기가 치환이 된 것이다.
탄소는 유기화학의 기초이고 모든 유기체에 존재한다. 수소와 결합을 하면 매우 다양한 탄화수소를 형성하고, 이 탄화수소들은 냉매, 윤활유, 용매등으로 사용되고, 플라스틱 석유화학과 화석연료로도 사용된다.
탄소가 산소와 수소와 결합을 하게 되면, 탄소는 설탕, 리그난lignan, 키틴chitin, 알코올, 지방, 에스터ester, 카로티노이드carotenoid, 테르펜terpene 등 매우 많은 생화학 화합물을 형성한다. 질소도 결합에 참여하면 알칼로이드alkaloid를 형성하게 되고, 황도 첨가되면 항생제, 아미노산, 고무 등을 형성하게 된다. 인 또는 다른 원소들을 포함하면 DNA나 RNA를 형성하고, 생물에서 에너지의 화폐인 ATP(adenosine triphosphate)를 이룬다.
무기화합물
보통 탄소를 함유하는 화합물 중에서 광물과 관련되거나 수소나 플루오린을 함유하지 않은 화합물은 고전적으로 유기 화합물이라 보지 않는다. 이들은 보통 탄소의 간단한 산화물로 이루어져있다. 가장 많은 산화물은 이산화탄소 (carbon dioxide, CO2)이다. 이산화탄소는 고대 지구 대기에서 주요한 성분중 하나였지만 현재 대기에서는 많지 않다. 이산화탄소는 물에 녹아 탄산carbonic acid(H2CO3)이 되는데 하나의 탄소에 단일 결합으로 연결된 산소의 화합물들이 그렇듯이 불안정하다. 그래서 탄산은 중간체로 존재하고, 공명-안정화된 carbonate(CO2−
3) 이온으로 존재한다. 어떤 중요한 광물들은 carbonate로 이루어져있는데, 방해석calcite이 그렇다. 이황화탄소(Carbon disulfide, CS2)도 비슷하다.
다른 흔한 산화물은 일산화탄소(carbon monoxide, CO)이다. 일산화탄소는 불완전 연소시에 발생하고 무색, 무취이 기체이다. 이 분자는 삼중결합을 가지고 있고 극성분자인데, 그 결과로 산소를 대신해서 헤모글로빈hemoglobin 분자에 결합하는 능력이 강하다. 시안화이온(Cyanide, CN–)도 비슷한 구조를 가지지만 행동은 할로젠이온들과 비슷하게 행동해서 pseudohalogen 이라고도 한다. 다른 산화물로는 아산화탄소(carbon suboxide, C3O2), 불안정한 일산화이탄소(dicarbon monoxide, C2O), 삼산화 탄소(carbon trioxide, CO3), 사이클로펜탄펜톤(cyclopentanepentone, C5O5), 사이클로헥산헥손(cyclohexanehexone, C6O6), mellitic anhydride(C12O9) 등이 있다.
텅스텐과 같은 금속과 반응을 하면 탄소는 카바이드 이온(carbide, C4–)이나 아세틸라이드 이온(C2−
2)을 형성하는데 합금의 녹는점이 높아진다. 이런 음이온들은 매우 약한 산인 메탄methane과 아세틸렌acetylene과 연관이 있고, 따라서 음이온들은 강한 염기이다. 전기음성도가 2.5 정도인 원소들과 탄소는 공유결합을 선호한다.
유기금속 화합물
유기금속 화합물은 그 정의에 의해 적어도 하나의 탄소-금속 결합이 있어야한다. 넓은 범위에 이런 화합물이 존재하는데 큰 클레스의 가장 간단한 알킬-금속 화합물인 사에틸납(tetraethyllead)이 있고, η2-alkene compounds인 Zeise's salt, η3-allyl compounds인 allylpalladium chloride dimer이 있다.
영어로 carbon인 이 이름은 석탄과 목탄을 뜻하는 라틴어인 carbo에서 왔다. 프랑스의 charbon은 목탄을 뜻한다. 탄소의 게르만어는 Kohlenstoff, 독일어 koolstof, 덴마크어 kulstof는 모두 '석탄-물질'로부터 왔다.
탄소는 문명이 시작되기 전부터 재와 목탄 등으로 알려져있었다. 다이아몬드는 아마도 중국에서 기원전 2500년 전부터 알려져있었고, 목탄은 로마 시대때 만들어져 사용되었다.
1722년 René Antoine Ferchault de Réaumur는 철이 강철로 될 때 어떤 물질을 흡수한다는 것을 보였는데, 오늘날 그것은 탄소였다. 1772년 라부아지에Antoine Lavoisier는 다이아몬드가 탄소의 한 형태라는 것을 보였다. 라부아지에가 목탄과 다이아몬드 시료를 태웠을 때 두개의 시료 모두 물을 생성하지 않고 같은 양의 이산화탄소를 만든다는 것을 보였다. 1779년 셸레Carl Wilhelm Scheele는 납의 한 종류로 알려졌던 흑연을 목탄과 같지만 약간의 철을 함유하고 있고 질산과 섞으면 산화해서 그의 표현으로 이산화탄소인 'aerial acid'를 만든다는 것을 보였다. 1786년 프랑스 과학자 베르톨레Claude Louis Berthollet와 몽주Gaspard Monge, 반데몬드C. A. Vandermonde는 흑연이 대부분 탄소로 이루어져있고 라부아지에가 다이아몬드를 산화시킨 것과 같은 방법으로 산소로 산화시킬 수 있음을 확인하였다. 라부아지에는 자신의 1789년 교과서에 탄소를 원서로 기제해놨다.
탄소의 새로운 동소체, 풀러렌은 1985년 발견되었다. 풀러렌은 버키볼과 나노튜브와 같은 나노구조를 포함한다. 발견한 사람들은 로버트 컬Robert Curl, 해럴드 크로토Harold Kroto, 리처드 스몰리Richard Smalley으로 1996년 노벨 화학상을 받았다. 다음을 클릭하면 1996년 노벨 화학상 연설문을 볼 수 있다.
'Elements' 카테고리의 다른 글
| 산소, Oxygen (0) | 2012.03.12 |
|---|---|
| 질소, Nitrogen (1) | 2012.01.20 |
| 붕소, Boron (1) | 2011.12.31 |
| 베릴륨, Beryllium (2) | 2011.12.26 |
| 리튬, Lithium (0) | 2011.06.11 |



