|
플루오린, Fluorine | |
|
원자 기호 |
F |
|
원자 번호 |
9 |
|
족, 주기, 구역 |
17족, 2주기, p-구역 |
|
전자배치 |
1s2 2s22p5 |
|
전자배치  | |
|
플루오린 기체는 연한 노란색이다. 아래는 액체 플루오린이다.  | |
|
플루오린의 방출 스펙트럼
 | |
|
원소 분류 |
할로젠 |
|
원자량 |
18.9984032(5) |
|
상태 |
기체 |
|
밀도 |
(0℃, 1기압) 1.696 g/L (끓는점에서) 1.505 g·cm−3 |
|
녹는점 |
53.53 K, −219.62 °C |
|
끓는점 |
85.03 K, −188.12 °C |
|
삼중점 |
144.4 K, 5.215 MPa |
|
융해열 |
0.510 kJ/mol |
|
기화열 |
6.62 kJ/mol |
|
열용량 |
(Cp) (21.1 °C) 825 J·mol−1·K−1 (Cv) (21.1 °C) 610 J·mol−1·K−1 |
|
산화수 |
-1 |
|
전기음성도 |
3.98 (폴링 척도) |
|
이온화에너지 |
1st: 1,681 kJ·mol−1
2nd: 3,374 kJ·mol−1
3rd: 6,147 kJ·mol−1 |
|
공유 반지름 |
64 pm |
|
반데르발스 지름 |
135 pm |
|
자기성 |
비자기성 |
|
열전도율 |
(300K에서) 0.02591 W·m−1·K−1 |
플루오린, Fluorine은 원자 번호 9, 원소 기호 F로 표현되는 화학원소이다. 우리말로는 예전엔 플루오르라고 했고, 불소(弗素)라고도 한다. 할로젠족에 속하는 원소들중 가장 가벼운 원소이며, 단 하나의 안정한 동위원소 플루오린-19만 있다. 표준상태에서, 플루오린은 연한 노란색 기체로 이원자 분자, F2로 존재한다. 항성에서 풀루오린은 다른 가벼운 원소에 비해 희귀하다. 지구 지각에서 플루오린은 흔해서, 13번째로 많은 원소이다.
플루오린이 들어간 광물인 형석, fluorite은 1530년에 제련을 하다가 공식적으로 처음 발견되었다. 광물의 이름은 라틴어로 흐르다(flow)라는 뜻을 가지고 있는 flow로부터 나왔는데, 그 이유는 fluorite형석이 금속괴의 녹는점을 낮추기 위해 사용되었기 때문이다. 1811년에 화학 원소로 제안되었고, 플루오린fluorin이라는 이름은 처음 발견한 광물의 이름에서 나왔다. 플루오린을 분리하려고 노력하다가 사고로 죽은 몇몇의 화학자를 '플루오린 순교자fluorine martyrs' 라고 한다. 1866년, 프랑스의 화학자 앙리 무아상Henri Moissan이 성공했다. 현재도 산업 생산에서 쓰이는 방법으로 그가 개발한 전기분해 방법으로 분리해냈다. 결국 앙리 무아상은 플루오린의 분리와 무아상 전기로 연구의 업적을 인정받아 1906년 노벨상을 수상하게 된다. 아래를 클릭하면 1906년 노벨 화학상 연설문을 볼 수 있다.
원소 플루오린의 주요 용도는 우라늄 농축으로 멘하튼 프로젝트에서 개발되었다.
플루오린은 가장 전기음성도가 큰 원소이고 헬륨과 네온을 제외한 모든 원소들과 안정한 플루오린화물fluoride 화합물을 형성한다. 원소 플루오린을 만들기가 어렵기 때문에, 대부분의 플루오린은 절대로 원소로 환원되지 않는다. 플루오르화 수소Hydrofluoric acid, HF는 130억 달러에 달하는 플루오린화학의 중간체로 중요한 물질이다. HF가 약산일지라도, HF는 유리를 녹이고, 일반적인 강산들 보다 화상 위험성이 더 크다. 가벼운 금속들의 플루오린화물은 이온 화합물(염)을 형성하고, 무거운 금속 원소와는 휘발성이 있는 분자를 형성한다. 무기 플루오르화물의 주요 용도는 제강(Steelmaking)과 알루미늄 정제이다.
유기 플루오린 화합물은 화학적, 열적으로 매우 안정한 경향이 있고 물을 싫어한다(repel water). 가장 많이 쓰인 용도는 프레온Freon과 같은 냉매 가스이다. 오존 구멍을 유발하는 클로로플루오르카본chlorofluorocarbon(CFC)가 금지되었지만, CFC를 대체하는 화합물인 hydrochlorofluorocarbon이나 hydrofluorocarbon은 여전히 플루오린을 함유하고 있다. 폴리테트라플루오르에틸렌은 테플론, Teflon이라고도 부르는데, 가장 중요한 플루오르 중합체이며, 전력 산업, 화학적으로 저항이 필요한 부분, 경기장 지붕, 요리기구 등에 사용된다. 플루오르화물은 표유류에게 필수 미네랄은 아니지만, 이가 썩는 것을 방지한다. 약들 중 점점 많은 양이 플루오린을 함유하고, 혈중 콜레스테롤 농도를 낮추는 Lipitor나 항우울제인 Prozac이 그 예이다.
물리적인 성질
플루오린은 실온에서 기체상의 이원자 분자를 형성한다. 밀도는 공기의 약 1.3배 정도 된다. 플루오린은 -188.1℃에서 액화해서 밝은 노란색 액체가 된다. 플루오린은 -219.6℃에서 얼어서 cubic 구조를 가지고 beta-fluorine이라고 부른다. 베타-플루오린은 투명하고 부드럽다. -227.5℃에서 플루오린은 고체-고체 상전이를 해서 monoclininc 구조가 되는데 alpha-fluorine 이라고 부른다. 알파-플루오린은 불투명하고 딱딱하며, 분자 층이 밀집되어있다. 고체-고체 상전이는 녹는점 전이보다 더 많은 에너지를 필요로 하고 폭발적일 수 있고, 시료가 마구 떨리고, 시료를 담는 통을 날려버리기도 한다. 일반적으로 고체 플루오린은 다른 할로젠보다 산소와 더 비슷하다.
때때로 황록색으로 언급되지만, 플루오린 기체는 실제로 매우 연한 노란색이다. 색깔은 농축된 플루오린 가스일 때 튜브의 긴축을 통해서만 관찰할 수 있다. 짧은 곳을 통해서 관찰하거나 대기중에서는 투명한 것처럼 보인다. 플루오린 원소는 코를 매우 자극하는 특징적인 냄새를 가지고 있는데, 20ppb 만큼 농도가 옅어도 맡을 수 있다.
동위원소
플루오린은 지구에서 단 하나의 안정한 동위원소인 플루오린-19만 자연적으로 존재해서 이 원소를 단일동위원소monoisotopic, 단일핵원소mononuclidic로 만든다. 17개의 방사성 동위원소가 합성되어졌는데, 원자량이 14~18, 20~31이다. 플루오린-18은 가장 안정한 방사성 동위원소로, 반감기가 109.77분이다. 그리고 가장 가벼우면서 홀수로 같은 수의 양성자와 중성자를 가진 불안정한 핵이다.
가장 가벼운 플루오린 동위원소인 14~16은 전자 포획으로 붕괴한다. 17F와18F는 양전자 방출을 하는 beta plus 붕괴를 한다. 안정한 플루오린-19보다 무거운 모든 동위 원소는 전자를 방출하는 beta minus 붕괴를 한다. 몇몇개는 중성자 방출을 통해 붕괴하기도 한다.
원자, 분자의 성질
플루오린 원자는 9개의 양성자와 9개의 전자를 가지며, 전자 배치는 [He]2s22p5으로 네온보다 전자 하나가 부족하다. 플루오린의 바깥 전자들은 상대적으로 서로서로 멀리 떨어져 있어서 핵의 양전하를 가려막지 않는다(가려막기 효과Link). 그러므로, 상대적으로 큰 유효핵전하를 가진다. 상대적으로 큰 유효핵전하를 가지기 때문에, 플루오린은 이온화하기 힘들며, 매우 안정한 네온꼴 배치를 이루기 위해 전자를 하나 더 가질려고 한다.
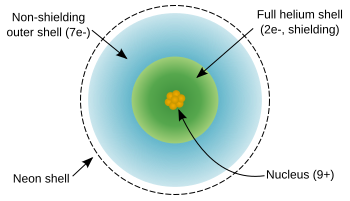
플루오린 원자의 구조
플루오린 원자로부터 전자 하나를 때어내 F+를 만드는데 필요한 에너지인 첫번째 이온화에너지는 1,681 kJ/mol로 헬륨과 네온다음으로 크다. 두번째, 세번째 이온화 에너지는 3,374 & 6,147kJ/mol이다. 전자 하나를 받아서 F–가 될 때 내놓은 에너지인 전자친화도는 328kJ/mol로 염소를 제외한 모든 원소들 중에서 제일 크다. 플루오린은 네온보다는 크고 산소보다는 작은 60pm의 매우 작은 공유결합 반지름을 가진다.
각각의 플루오린 원자는 1개의 홀전자를 가지고 있지만, 플루오린 분자는 모든 전자가 짝이 지어져있다. 그래서 원소 플루오린은 자석에 끌리지 않는 반자성이다. 이와는 반대로 바로 옆에 붙어 있는 산소 원소는 상자성으로 자석에 끌린다. 실험으로 구한 플루오린의 자화율은 −9.6×10−6 cgs으로 이론적인 예측과 매우 비슷하다. 실험 결과는 1999년이 될 때까지 구하지 못했는데, 그 이유는 플루오린 기체에 상자성이 있는 산소를 제거하기가 매우 어려웠기 때문이다. 플루오린의 가장 바깥에 있는 전자들은 두번째 에너지 준위에 있어서, d-궤도함수로 도약하지 못한다. 이런 성질은 플루오린을 1의 결합차수를 가지게 한다. 할로젠 중에서 염소는 3d-궤도함수로 도약할 수 있어서 결합 차수가 1.12이다.
| Molecular fluorine | ||
 |
 |
 |
| 고체 알파-플루오린 결정 구조 | 가운데는 플루오린 기체의 색, 왼쪽은 비교하기위한 기체의 색, 오른쪽은 염소이다. | 플루오린 분자의 분자 오비탈은 모든 전자가 짝지어져있다. |
화학적 성질
| X | XX | HX | BX3 | AlX3 | CX4 |
|---|---|---|---|---|---|
| F | 159 | 574 | 645 | 582 | 456 |
| Cl | 243 | 428 | 444 | 427 | 327 |
| Br | 193 | 363 | 368 | 360 | 272 |
| I | 151 | 294 | 272 | 285 | 239 |
플루오린 화학은 전자를 얻는 경향성이 지배적이다. 가장 전기음성도가 큰 원소이고, 강한 산화제이다. 플루오린으로부터 전자 하나를 제거하는 것은 엄청난 에너지가 필요하기 때문에 알려진 그 어떤 산화제도 플루오린의 산화수를 +로 만들 수 없다.
산화력이 강하고 F-F 결합력이 상대적으로 약하기 때문에 플루오린은 대부분의 물질과 반응을 하여 다른 원자들과 강한 결합을 형성한다. 결합 에너지는 과산화물의 O-O 결합이 끊어지는 것 또는 하이드라진의 N-N 결합이 끊어지는 것처럼 낮으며, Cl-Cl이나 Br-Br 보다 매우 낮다. F2의 공유결합 반지름은 71pm 정도로 다른 화합물보다 굉장히 큰 편인데, 플루오린 원자 간의 결합이 약하기 때문이다.
플루오린이 들어가는 반응은 대부분 급작스럽고, 폭발적이다. 강철 가루나, 유리 조각, 석면asbestos처럼 일반적으로 반응성이 없는 물질도 차가운 플루오린 기체에 의해 쉽게 부식된다. 나무나 심지어 물도 플루오린 제트jet 속에서는 스파크 없이도 발화한다.
플루오린은 네온과 헬륨을 제외한 모든 원소와 화합물을 형성해 fluoride플루오르화물이 된다. 아스타틴At과 프랑슘Fr을 제외한 원자 번호 99번인 아인슈타이늄Es 까지 확인되었다. 플루오린은 104번인 러더퍼듐Rf, 106번인 시보귬Sb와도 화합물을 형성한다고 알려졌다. 몇몇 무거운 방사성 원소들은 플루오르화물을 형성하는지 확인되지 않았는데, 이 원소들이 너무나도 희귀하기 때문이다. 하지만 이론적으로는 모두 반응을 하여 형성이 가능하다.
모든 금속은 플루오린과 반응하지만 금속마다 조건이 다르다. 대부분의 금속은 파우더로 반응을 시켜야하는데, 금속 표면에 플루오르화물 피막이 형성되어 피막 안쪽으로는 플루오르화가 일어나지 않기 때문이다. 알칼리 금속은 플루오린과 폭발적으로 반응한다. 알칼리 토금속은 실온에서도 잘 반응하지만 많은 열을 방출하지 않는다. 귀금속noble metal인 루테늄, 로듐, 팔라듐, 백금, 금은 순수한 플루오린 기체와 300~450℃에서 쉽게 반응한다.
플루오린은 알칼리 금속처럼 수소와 폭발적으로 반응한다. 할로젠도 비활성기체인 라돈처럼 플루오린 기체와 반응을 한다. 그보다 좀더 가벼운 비활성 기체인 제논과 크립톤도 특별한 조건에서는 플루오린과 반응하며, 아르곤도 HF와 결합을 할 수 있다. 삼중결합으로 매우 안정한 질소도 전기 방전과 높은 온도에서는 플루오린과 바로 결합을 할 수 있다.
기원과 존재량
우주
| 원자번호 | 원소 | 상대적인 존재량 |
|---|---|---|
| 6 | 탄소 | 4,800 |
| 7 | 질소 | 1,500 |
| 8 | 산소 | 8,800 |
| 9 | 플루오린 | 1 |
| 10 | 네온 | 1,400 |
| 11 | 소듐(나트륨) | 24 |
| 12 | 마그네슘 | 430 |
우주론적인 관점에서 플루오린은 우주에 400ppb 정도로 상대적으로 드문 원소이다. 항성 안에서, 생성된 모든 플루오린은 핵합성으로 제거된다. 수소와 반응하여 산소와 헬륨을 만들거나, 헬륨과 반응하여 네온과 수소를 만든다. 항성 외각에 일시적으로 존재하는 플루오린은 미스테리인데, 플루오린을 파괴하는 반응들을 탈출해야 그곳에 있을 수 있기 때문이다.
이 미스테리를 풀기위한 세가지 이론이 있다. Type II 초신성폭발에서 네온 원자들이 폭발중에 중성자들에게 맞아서 플루오린이 된다는 이론이 있다. 태양보다 40배 무거운 푸른 항성인 Wolf-Rayet star은 강한 태양풍으로 플루오린을 수소나 헬륨이 파괴하기 전에 나려버린다는 이론이 있다. 적색 거성인 asymptotic giant branch에서 핵합성이 펄스로 일어나 플루오린이 밖으로 운반된다는 가설이 있다. 오직 적색 가성일 때만 이런 증거들이 관찰된다.
플루오린의 화학적 반응성때문에 지구에서 원소로써 존재하진 않지만 성간물질에서는 발견된다. 플루오린 양이온은 행성 성운, 항성 그리고 태양에서도 발견된다.
지구
플루오린은 지구 지각에서 13번째로 흔한 원소로, 질량으로 따졌을때 600~700ppm 정도 존재한다. 반응성 때문에 원소보다는 플루오르 이온으로 발견된다. 플루오린을 생성하는데 산업적으로 사용되는 세가지 광물은 형석fluorite, 불소인회석fluorapatite, 빙정석cryolite이 있다.
- 형석 Fluorite (CaF2), 영어로는 fluorspar 또는 Blue John라고 부르며, 상업적으로 생산하는 플루오린의 주된 원천이다. 형석은 색이 잇는 광물로 열수 광상 hydrothermal deposits과 관련이 있다. 형석은 전세계적으로 발견되고 흔해서, 많은 나라가 형석을 생산한다. 중국은 전세계 수요의 절반 이상을 공급하고, 멕시코가 두번째로 많이 공급한다. 미국은 20세기에 가장 많이 공급하는 나라였지만 일리노이에 있는 마지막 광산이 1995년에 문을 닫았다. 캐나다도 1990년도에 생산을 종료했다.
- 불소인회석 Fluorapatite (Ca5(PO4)3F)은 인을 포함한 다른 인회석apatite과도 같이 발굴되었는데 주된 사용은 비료이다. 지구에 있는 대부분의 플루오린은 대부분 광물로 존재하지만, 광물에 있는 플루오린의 양은 3.5%로 매우 적기 때문에 플루오린은 쓰레기로써 버려진다. 오직 미국만이 회수한다. Hexafluorosilicate(H2SiF6)는 부생성물로 생산되는데 도시의 물의 불소화에 사용된다.
- 빙정석 Cryolite (Na3AlF6)은 셋 중에서 가장 적지만, 플루오린이 가장 많이 농축되어있다. 빙정석은 알루미늄 생산에 사용되었다. 그런데 주된 상업용 광산인 그린랜드 서쪽 해안에 있던 것이 1987년에 폐쇄되었다.
| 플루오린을 함유한 주요 광물 | ||
 |
 |
 |
| 형석 Fluorite |
불소인회석 Fluorapatite |
빙정석 Cryolite |
보석의 일종인 토파즈같은 몇몇 다른 광물도 플루오르화물을 포함한다. 다른 할로젠과는 다르게 플루오르화물은 해수나 염수에서 많지 않다.
유기플루오르화물은 화산폭발이나 온천에서 발견된다. 이런 화합물의 생성 기원은 확실치 않다. 이런 화합물은 플루오린 생산에 상업적으로 사용되진 않는다.
역사
플루오린의 영어 이름 Fluorine은 플루오린을 생산하는데 쓰는 광물의 라틴 이름에서 왔다. 형석Fluorite는 독일의 광산학자 게오르기우스 아그리콜라Georgius Agricol가 금속괴와 슬래그의 온도를 낮추는데 써서 flux라고 했다. 형석은 독일에서 그 시대에 schone flusse라고 불렀다. 그런데 16세기 아그리콜라가 라틴어으로 표현을 했다. 돌에 대해서 그는 이 돌이 불속에서 금속괴를 흐르게 만든다고 해서 라틴어 동사 흐르다는 뜻을 가지는 fluo에서 온 fluores라고 부를 것을 제안했다. 아그리콜라 후에 광물은 fluorspar라고 부르게 되었고, 현재 fluorite라고 부른다.
독일의 유리 세공사인 Heinrich Schwanhard가 처음으로 플루오르화수소산(불소산)hydrofluoric acid을 생산했다고 주장한다. Heinrich Schwanhard가 쓴 글을 보면 fluorite에 대해서 특별한 언급은 없었고 단지 매우 강한 산에 대한 설명만 있다. 그래서 어쩌면 유리를 조금 부식시킬 수 있는 질산이나 왕수에 대한 설명이 아니였을까 추정하기도 한다. 안드레아스 마르그라프Andreas Sigismund Marggraf가 1764년에 처음으로 현재 플루오르산hydrofluoric acid이라고 부르는 플루오린산fluoric acid을 만들었다고 기록한 첫번째 사람이며, 유리에 담겨진 황산에 가열한 형석을 넣었더니 생성된 물질이 유리를 매우 부식시켰다고 보고했다. 1810년 프랑스 물리학자 암페어André-Marie Ampère가 이 산은 수소와 염소와 비슷하지만 알지 못하는 어떤 원소의 화합물일 것이라고 제안했다. 그 후에 형석은 플루오르화 칼슘으로 되어있다고 조성이 밝혀졌다.
험프리 데이비 경Sir Humphry Davy은 플루오린산fluoric acid로부터 끝을 -ine로 바꾸어서 다른 할로젠과 비슷하게 플루오린이라는 이름을 제안했다. 라틴어로는 새롭게 fluorum이라 했고 여기서 현재의 원소 기호 F가 나왔다. 아주 옛날 논문에서는 원소 기호를 Fl으로도 표현을 했다. 현재 Fl 이라는 기호는 114번 원소인 우눈쿼듐ununquadium의 기호로 제안되고, 정해지진 않았지만 플레로븀flerovium이라고 제안되고 있다.
엄청난 반응성 때문에 원소 플루오린은 수년동안 분리되지 못했다. 플루오린 원소를 분리하는 과정은 매우 느렸는데, 전기분해방법으로밖에 분리할 수 없었고 발생한 기체가 대부분의 물질과 반응해버렸기 때문이다. 원소 플루오린의 생성은 매우 위험하단 것이 증명이 되었는데, 초기 실험자들을 죽이거나 실명시켰기 때문이다. 더서드Jean Dussaud는 이들을 '플루오린 순교자 fluorine martyrs' 라고 불렀고, 이 용어는 아직도 사용된다.
프레미Edmond Fremy는 순수한 플루오르수소산에 전기를 흐르면 될 것이라고 생각을 했다. 전에는 플루오르산이 수용액으로만 공급이 되었다. 프레미는 물이 없는 플루오르산을 발생시키기 위해서 potassium bifluoride(KHF2)를 추가했다. 하지만 불행하게도 발생한 순수한 플루오르산은 전기가 흐르지 않았다.
프랑스 화학자 앙리 무아상Henri Moissan은 프레미의 학생중 한명이였다. 그는 나중에 많은 접근 방법을 연구했는데, 페르미가 시도했던 HF와 KHF2를 섞는 방법을 기초로 해서 연구했다. 최종 용액은 전기가 흘렀다. 무아상은 백금과 이리듐의 합금을 만들어 부식에 강한 장비들도 만들었다(순수한 백금보다도 플루오린에 대한 저항성이 컸다). 74년 동안 플루오린을 분리하려는 화학자들의 연구 끝에, 1886년 6월 26일 무아상이 원소 플루오린을 분리해냈다고 보고했다. 무아상은 프랑스 아카데미에 보고한 보고서에서 다음과 같이 썼다.
발생한 이 기체에 대해서 여러 가정을 할 수 있다. 하지만 가장 간단한 설명은 아마도 우리는 플루오린이 존재하는 곳에 있다는 것이다.
One can indeed make various hypotheses on the nature of the liberated gas; the simplest would be that we are in the presence of fluorine
무아상은 플루오린을 만들기 위한 장비를 덜 비싼 것으로 개선시켰는데, 구리 장비를 플루오르화구리로 코팅한 것을 썼다. 1906년 그가 죽기 2달 전, 무아상은 플루오린의 분리와 무아상 전기로 연구로 노벨 화학상을 수상했다.
1930년대와 1940년대 동안, 듀퐁DuPont社는 유기플루오르화물을 대량으로 판매하기 시작했다. 제네럴 모터스General Motors의 연구자들이 염화플루오르화탄소chlorofluorocarbon, CFC가 냉매로 쓸 수 있다는 것을 알아낸 후, 듀퐁社는 프레온-12, Freon-12를 대량으로 생산했다. 듀퐁社와 GM은 이 새로운 생성물에 대한 시장을 공략하기 위해서 1930년에 같이 사업을 시작했고, 1949년에 듀퐁사는 사업을 포기했다. 프레온은 시장에서 대히트를 쳤고, 전에 냉장고에서 쓰고 독성이 있던 냉매를 대체했고 주방 냉장고 시장이 커졌다.
1938년에 폴리테트라플루오로에틸렌polytetrafluoroethylene(듀퐁의 상품명 테플론, Teflon)이 듀퐁社에 고용된지 얼마 안된 플렁켓Roy J. Plunkett박사가 사고로 만들어냈다. Tetrafluoroethylene 기체를 가지고 연구하다가 무게를 잘못 쟀다. 상자 안을 긁었을 때 세상에 처음 만들어진 중합체를 찾았다. 이 새로운 중합체는 다른 물질에 비해서 높은 온도에서 부식에 강했다. 사고로 만든 이 물질은 1941년 초기에 상품이 되었다.

맨허튼 프로잭트, 테네시에 있는 Oak Ridge에 있는 기체 diffusion plant K-25
2차 세계대전동안에 원소 플루오린 대량으로 생선되기 시작했다. 독일이 전기분해로 chlorine trifluoride을 수 톤을 생산해냈고, 화합물은 발화물질로 사용되었다. 미국의 맨허튼 프로젝트에서 플루오린은 우라늄 분리를 위해 더 많이 생산되었다. 기체상의 육플루오르화 우라늄uranium hexafluoride은 우라늄-235를 분리하기 위해 사용되었다. 우라늄-235는 핵폭발에 있어 중요한 물질이며, 더 무거운 우라늄-238을 원심분리와 확산 공장에서 분리했다. Uranium hexafluoride는 부식성이 있는 플루오린을 적은양을 방출했기 때문에, 분리 공장은 특별한 물질로 지어져야 했다. 모든 파이프는 니켈로 코팅되었고, 연결부위와 유연해야하는 부분은 테플론이 사용되었다.
1958년, 듀퐁의 테플론 사업의 연구자 고어Bill Gore는 전선 단열제로 테플론으로 개발되는 것을 원하지 않아 회사를 떠났다. 고어의 아들 로버트Robert는 전선 코팅 문제를 해결하는 방법을 찾고, W. L. Gore and Associates회사가 탄생했다. 1969년 로버트 고어는 확장된 PTFE 막을 개발했고, 이것은 나중에 공기가 통하는 우비(breathable rainwear)에 사용하는 고어텍스Gore-tex가 되었다. 이 회사는 PTFE를 사용한 많은 제품을 개발했다.
1970년대와 1980년대에 오존층을 파괴하는 CFC의 역할이 알려지고 사람들이 걱정을 했다. 1996년에 이르러 거의 모든 나라는 CFC 냉매의 사용과 생산을 금지했다. 하지만 플루오린이 들어간 물질이 냉매로써 계속 사용되어 hydrochlorofluorocarbons(HCFCs)나 hydrofluorocarbons(HFCs)가 개발이 되어 CFC를 대체했다.
플루오르 화학의 전세계 시장 규모는 2006년~2008년 기간에 매년 130억 달러이다. 역사적으로 산업이 매 년 몇 퍼센트씩 성장을 했고, 미래에도 그와 비슷하게 성장을 할 것이라 예상된다. 플루오린화학이 2008~2009년에 경기 침채로인해 약간 수축되었지만, 2015년에는 매년 26억톤에 도달할 것이라 예측된다.
가장 큰 시장은 미국이다. 서부 유럽은 두번째로 큰 시장이다. 아시아는 가장 빠르게 성장하는 지역이다. 중국은 가장 빠르게 성장하는 시장이며, 그만큼 생산도 많이 하고 있다.
형석 광산은 2003년까지 5500억 달러로 추산되었고, 매 년 45억톤이 채광되었다. 대부분의 광석들은 형석을 농축시키고 추출시켜야 한다. 채광된 형석의 두가지 등급이 있는데, 둘 다 같은 양을 생산한다. Acidspar 는 적어도 97%가 CaF2이며, metspar는 그보다 순도가 낮다.
Metspar는 철 제련에 많이 쓰이고, Acidspar는 황산과 반응을 시켜서 HF로 바꾼다. 생성된 HF는 유기플루오르화물이나 합성 빙정석을 생산하는데 대부분 쓰인다. 형석의 1% 정도만이 플루오르 원소로 전환된다.
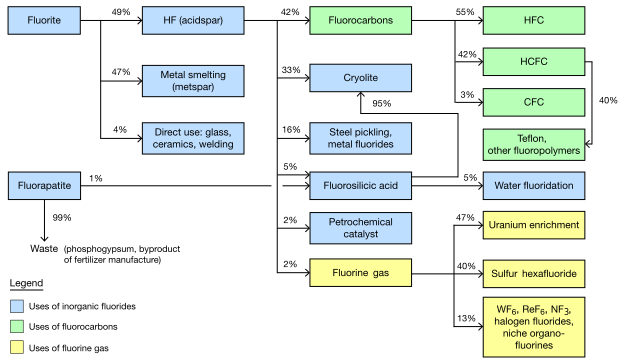
플루오린 산업의 공급 체인.
무기 플루오르화물의 사용
Metspar 등급의 형석 3kg 정도는 1톤의 강철을 만들기 위해 사용된다. CaF2 의 이온 형태는 녹는점과 점성이 낮다. 형석으로부터 나온 칼슘은 황과 인을 제거하는것을 도와주며, 강철이 필요로 하는 석회석과 같은 역할도 한다. Metspar는 철 생산이나 철을 포함한 합금에 사용된다. Metspar는 순도가 다양한데 최근에는 선진국에서 CaF2 함유랑이 높은 metspar를 쓰는 경향이 있다. 미국에서는 상업용으로는 metspar가 일반적으로 순도 80%에서 93%까지 사용된다. 전세계적으로 metspar는 적어도 60% 순도가 사용된다.
Acidspar 등급의 형석은 세라믹, 에나멜, 유리섬유나 시멘트 등에 첨가물로 바로 사용된다. 세라믹 등급으로 사용되는 형석은 CaF2의 90% 또는 95%가 사용된다. 또 acidspar는 대부분의 플루오린의 함유한 화합물의 전구체가 되는 플루오르화수소산을 만드는데 사용된다.
플루오르화탄소의 사용
유기 플루오르화물을 만들기 위해서 채굴된 형석의 20%이상, 만들어진 HF의 40%이상이 사용된다. 유기플루오르화물은 거의 냉매로 사용되는 것이 지배적이고, 냉매를 만들기위해서 80%의 HF를 사용한다. CFC가 전세계적으로 금지되었지만, CFC를 대체하는 냉매가 여전히 플루오린을 함유한 분자이기 때문이다. 플루오르 중합체는 플루오린 사용량이 냉매의 4분의 1밖에 안되지만, 빠르게 성장하고 있다. 불소계면활성제Fluorosurfactant는 매우 적은양이 사용되지만 매우 비싸기 때문에 경제적으로 중요한 의미를 가진다.
냉매
전통적으로 CFC는 플루오린화된 유기물질의 대부분이였다. CFC는 분재 내의 플루오린, 염소, 탄소, 수소의 양으로 구별되었다. 프레온Freon이라는 용어는 CFC나 비슷한 할로젠화된 분자의 통칭이다. 하지만 엄격하게는 듀퐁社의 상품명에서 나왔다. 상품명은 R을 맨 앞에 쓰는 식으로 정해졌다. 가장 많이 사용된 CFC는 R-11(trichlorofluoromethane), R-12 (dichlorodifluoromethane), 그리고 R-114 (1,2-dichlorotetrafluoroethane)가 있다.
CFC는 1980년대까지 냉장고와 에어콘, 그리고 추진체나 용매로써 많이 사용했다. 하지만 CFC가 대부분의 나라에서 금지되면서 CFC 산업이 급격히 추락했다. 21세기 초에 들어서 CFC 생산량은 1980년대 최고일 때의 10%도 못하고, 오로지 다른 화합물을 합성하기위한 전구체로써만 사용된다. CFC의 금지는 형석의 요구를 크게 축소시켰지만 21세기에 들어서 1980년대의 요구량을 회복했다.
하이드로클로로플루오로카본Hydrochlorofluorocarbons(HCFCs) 과 하이드로플루오로카본hydrofluorocarbons(HFCs)은 CFC 냉매를 대체하여 사용된다. 현재 유기물질 합성에 쓰이는 플루오린의 90%이상이 이 두가지 종류로 사용된다. 많이 쓰이는 HCFC는 R-22 (chlorodifluoromethane)과 R-141b (1,1-dichloro-1-fluoroethane)이며, HFC는 R-134a (1,1,1,2-tetrafluoroethane) 이다.
브로모플루오로알케인bromofluoroalkane의 일종인 할론, Halon(bromotrifluoromethane)은 배나 비행기에서 기체 소화기 시스템으로 사용된다. 할론의 생산은 1994년에 금지되었기 때문에 시스템은 금지되기 전에 생산한 것 또는 재활용하여 사용한다.
플루오로중합체, 불소중합체
플루오로중합체Fluoropolymers는 전체 중합체중에 0.1%를 차지한다. 하지만 플루오로중합체는 전체 중합체 평균보다 더 비싸고, 성장 속도가 빠르다. 2006~2007년경, 전세계 플루오로중합체 생산 추산은 매년 10만~18만톤 이상이다.
PTFE (polytetrafluoroethylene)는 전세계 플루오로중합체 생산의 60~80%를 차지한다. 테플론Teflon이라는 용어는 이 물질을 지칭할때 주로 쓰이지만, 듀퐁社의 상품명이다.
플루오린 기체의 사용
G7 국가에서 플루오린의 1만 7천톤은 11개의 회사에서 1년동안 생산한다. 플루오린은 상대적으로 비싸지 않아서, 육플루오르화 우라늄이나 육플루오르화 황으로 판매 될때 1kg에 5~8 달러정도 든다. 보관과 취급이 어렵기 때문에 순수한 플루오린 기체는 매우 비싸다.
원소 플루오린은 핵연료 생산에 사용되는 육플루오르화 우라늄uranium hexafluoride의 생산이다. 화합물을 얻기 위해서 이산화 우라늄uranium dioxide을 플루오린산에 처리하는 것으로 사플루오르화 우라늄uranium tetrafluoride을 만든다. 사플루오르화 우라늄을 플루오린 기체에 노출시켜서 육플루오르화 우라늄을 만든다. 플루오린은 동위원소가 단 하나밖에 없어서 우라늄 농축에 유용한데, 육플루오르화 우라늄 분자가 오로지 우라늄-235와 우라늄-238의 무게 차이로 분리할 수 있기 때문이다. 우라늄-235와 우라늄-238을 분리하기 위해서 확산과 원심분리를 통해 질량 차이를 이용한다. 매년 플루오린 기체의 7천톤이 이 과정에 사용된다.

플루오린 기체가 두번째로 많이 사용되는 곳은 고전압 전원에 유전체로 사용되는 육플루오르화 황sulfur hexafluoride이다. SF6 기체는 공기보다 유전체 성능이 좋다. 극단적으로 반응성이 없고 유독한 화학물질인 PCB가 없다. 육플루으르화 황은 방음 유리창에도 사용되고, 전자공학 산업이나 의료, 군산업에서도 사용된다. 플루오린 기체를 사용하지 않고 화합물을 만들 수 있지만 순수한 황과 순수한 플루오린 기체의 반응은 무아상에 의해 처음 개발되어서 여전히 상업적으로도 사용된다. 매년 6천톤의 플루오린 기체가 소비된다.
원소 플루오린으로부터 만들어지는 몇몇 화합물은 전자공학 산업에 사용된다. 레늄이나 텅스텐의 육플루오르화물은 화학증착에 사용된다. 테트라플루오르메테인Tetrafluoromethane은 반도체 생산과정중 플라즈마 에칭plasma etching으로 사용된다.
플루오린 기체의 생산

영국, Preston에 위치한 F2 Chemical에 있는 플루오린 생산 라인
플루오린 기체의 상업적 생산은 무아상이 개발한 전기분해 방법으로 약간 개발시켜 진행된다. 기체가 가지는 부식성 때문에 보관과 취급에 있어서 특별한 주위가 필요하다.
전기분해 합성법
원소 플루오린 몇천톤이 HF안에 있는 KF의 전기분해로 매년 생산된다. 이플루오린화 포타슘Potassium bifluoride은 HF와 KF가 함께 있으면 저절로 생성된다.
적절한 양의 혼합물 조성인 KF•2HF은 70℃에서 녹고 70℃와 130℃에서 전기분해 된다. 이플루오린화 포타슘은 용액의 전기 전도도를 증가시키고 음극에서 플루오린 기체가 되는 이플루오린화 음이온을 생성한다. 만약 HF만 전기분해시킨다면 양극에서 수소 기체만 생성되고 플루오린 이온은 용액 속에 남아있는다. 전기 분해가 끝나면 플루오린화 포타슘만이 용액에 남게 된다.
최신 공법은 강철 컨테이너를 양극으로, 탄소막대를 음극으로 사용한다. 탄소 전극은 알루미늄의 전기분해와 비슷한 것을 사용한다. 무아상이 만든 초기 공법은 백금 금속을 전극으로 사용했다. 전기분해를 할 때 전압은 8~12V 사이이다.
취급법

실험실에서 플루오린을 보관하는 니켈 탱크와 파이프.
순수한 플루오린 기체는 안쪽이 플루오린화 금속 피막으로 보호할 수 있어 강철 실린더로 보관할 수 있다. 피막이 형성된 강철은 200℃ 이하에서 잘 견딜 수 있다. 하지만 그 이상의 온도라면 니켈, Nickel이 필요하다. 조절 벨브는 니켈로 만든다. 플루오린 파이프는 보통 니켈 또는 니켈과 구리의 합금인 모넬, Monel로 만든다.
모든 표면이 피막이 형성되어 있도록 해야하고, 그 어떤 물과 기름기(grease)를 피해야한다. 실험실에서는 플루오린 기체는 압력이 낮은 체로 수분을 제거한 유리 튜브로 사용할 수 있다.
제법
1986년, 플루오린 발견 100주년 기념일에 열리는 컨퍼런스를 준비하던 Karl Christe는 화학 반응을 통해 순수한 플루오린 기체를 발생시키는 법을 발견했다. 그는 그의 논문에서 실제 이 반응이 알려지기 50년 전부터 반응의 기초는 알려져 있었다고 말했다. 플루오린을 만들기 위해서 과학자는 우선 과플루오린화망가니즈(IV) 착화물perfluoromanganese(IV) complex을 준비해야한다. 오플루오린화 비소antimony pentafluoride로 처리를 하고 150℃까지 가열을 하면 플루오린 기체가 발생한다.
2 K2MnF6 + 4 SbF5 → 4 KSbF6 + 2 MnF3 + F2↑
하지만 이 합성 방법은 잘 사용되지 않는다.
생물학적 용도

남아프리카의 기프블라gifblaar는 플루오린 화합물을 만드는 몇 안되는 유기체이다.
플루오린은 포유류와 인간에게 필수 원소가 아니다. 적은 양의 플루오린은 뼈의 강도에 도움이 되지만, 인공 식단으로 만들었을 때는 문제가 된다.
몇가지 플루오린의 생물학적 용도가 있다. 플루오린은 충치 예방을 위해 널리 쓰였다. 약학과 농업에서 플루오린은 새로운 분자를 만들 때 쓰인다. 플루오린이 가진 독성은 곤충이나 성치류를 죽이는 것으로 잘 알려졌다. 산소를 함유한 과플루오린화탄소는 사람이 호흡할 수 있는 액체로써 현재 가능성이 있다.
치과 치료
이에 닿은 플루오린화 이온은 불소인회석fluorapatite을 형성하여 충치를 막는다. 에나멜을 부분적으로 미네랄화해서 충치에 대한 저항성을 크게 만든다. 직접 닿는 것만이 효과가 있고 플루오린화 이온을 삼키는 것은 이에 도움이 되지 않는다.
플루오린화 소듐Sodium fluoride, 플루오린화 주석(II)tin(II) fluoride과 가장 흔한 sodium monofluorophosphate이 치약에 쓰인다. 1955년에 처음으로 플루오린이 들어간 치약이 미국에서 나왔다. 현재 선직국의 거의 대부분 치약은 플루오린이 포함되어있다. 그 예로 유럽 치약의 95%가 플루오린을 함유하고 있다. 젤과 거품도 머리에 방사성 치료를 받는 환자를 위해서 사용될 수 있다. 환자는 고용량의 플루오린 치료를 받는다. 플루오린화물은 가글에도 포함되어 있으며, 불소화된 물을 사용한 음식에서도 소량이 남아 있을 수 있다.
불소화 물은 충치를 줄이기 위해 상수도에 플루오린을 첨가하는 방법이다. 1940년대에 시작되었고, 불소화된 물을 사용한 지역의 아이들을 상대로 연구가 진행되었다. 미국 인구의 2/3이 사용하는 상수도에서 불소화 정책을 사용하고 있고, 전세계 인구의 5.7%가 사용하고 있다. 불소침착증보다는 약한 부작용이 있을 수 있다. 불소화정책은 윤리적, 안정성 그리고 효험에 대해서 논쟁이 있다.
제약

Difunisal은 반감기가 13시간으로 대부분의 비스테로이드계 항염제 약들보다 매우 긴 반감기를 가진다.
몇몇 중요한 약들은 플루오린을 함유한다. C-F 결합이 매우 안정하기 때문인데, 플루오린이 포함된 많은 약들은 대사작용을 방지하고 더 긴 반감기를 가진다. 그 예로 방향족 고리는 약의 대사작용을 방해하기 위해 첨가될 수 있다. 하지만 몸에 있는 효소가 방향족 고리를 독성이 있는 에폭사이드로 대사시킬 수 있어 안정성에 문제가 있다. 플루오린을 위 사진처럼 파라para 위치로 첨가하면 방향족 고리가 에폭사이드로 되는 것을 막을 수 있다. 플루오린이 첨가되면 C-H 결합보다 C-F 결합이 소수성이 더 크기 때문에 친지방성이 증가한다. 소수성이 커지면서 세포막 투과율이 증가하기 때문에 약의 셍체이용률이 증가한다. C-F 결합이 강하기 때문에 유기플루오르화물은 일반적으로 매우 안정하고 플루오린이 이탈기로써 떨어져 나오는 것은 분자 어디에 위치해있냐에 따라 달라진다.
지난 50년간 상업화된 약의 5~15%만이 플루오린을 함유하고 있지만 플루오린을 함유한 약의 비율은 점점 증가하고 있다. 그 예로 플루드로코르티손fludrocortisone은 알도스테론aldosterone을 흉내낸 약인 가장 흔한 전해질코르티코이드mineralocorticoids이다. 합성 코르티코스테로이드corticosteroids의 일종으로 항염제인 덱사메타존dexamethasone과 트리암시놀론triamcinolone도 역시 플루오린을 함유하고 있다. 몇몇 흡입하는 마취제도 역시 플루오린을 함유하고 있다. 세보플루란sevoflurane, 데스플루란desflurane, 이소플루란isoflurane 모두 플루오린을 함유한 마취제이다.
시프람citalopram, 렉사프로escitalopram, 플루옥세틴fluoxetine, 플루복사민fluvoxamine, 파록세틴paroxetine처럼 많은 SSRI 항우울제는 플루오린을 함유하고 있다.
독성
합성된 플루오로아세테이트 소듐염sodium fluoroacetate은 포유류에 기생충들에게 효과가 있는 살충제로 사용된다. '1080' 이라는 이름은 독성 카테고리 중 하나를 언급하는 거였지만 이제는 상품명이 되었다. 플루오로아세트산염은 Krebs cycle에 중요한 역할을 하는 아세트산염과 비슷하게 생겼다. 플루오로아세트산염은 사이클을 멈추고, 세포가 에너지가 없는 상태로 만든다. 몇몇 다른 살충제는 플루오로아세트산염보다 독성이 매우 덜한 NaF를 포함한다.
생물학적으로 합성된 유기플루오르화물은 미생물이나 식물에서만 발견되고 동물에서는 발견되지 않는다. 가장 흔한 예는 플루오로아세트산염으로 초식동물에 대항하는 호주, 브라질, 아프리카의 적어도 40개의 식물이 가지고 있다.
촬영

플루오린-18을 이용한 전신 PET 촬영
자연에서 플루오린의 동위원소는 플루오린-19 단 하나만 있다. 플루오린 화합물은 NMR에서도 자주 사용되는데 플루오린-19의 핵스핀이 1/2이고 높은 자기회전비magnetogyric ratio를 가지고 있기 때문이다.
플루오린은 원소를 제외한 모든 화합물에서 -1의 산화수를 가진다. 다른 원자와 플루오린은 극성 공유 결합 또는 이온 결합을 형성한다. 대부분 플루오린은 단일 공유 결합을 형성한다. 더 많은 결합을 할 수도 있는데, 그 예로 BF(boron monofluoride)는 삼중결합을 형성한다. 플루오린화 이온은 두 금속 사이에 다리놓는 리간드가 될 수 있다. 플루오린을 함유한 분자는 수소 결합을 할 수 있다. 플루오린은 수소, 금속, 비금속, 심지어 비활성 기체와도 반응을 할 수 있다.
무기화합물
플루오린화 수소, Hydrogen fluoride

플루오린화 수소와 물의 혼합물이 어는 점 : 화살표가 가르키는 곳은 고체의 조성을 나타낸다.
플루오린을 수소와 섞으면 플루오린화 수소, HF 또는 수용액상에서는 플루오린화 수소산(불산)이 된다. H-F 결합은 수소 결합을 할 수 있는 세 종류(N, O, F) 중 하나이다. 수소 결합은 플루오린화 수소의 특유한 특징을 결정짓게 해준다. 때때로 물과 비슷한 성격을 가지고, 또 다른 때는 HCl 과 같이 다른 할로젠화 수소의 성질도 가진다.
HF 분자 사이의 수소 결합은 액체상에서 높은 점성도와 기체상에서 예상했던 것보다 낮은 압력을 갖게 만든다. 다른 할로젠화 수소들은 -85℃에서 -35℃ 사이에서 끓지만 HF는 20℃가 되어도 끓지 않는다. HF는 물과 잘 섞이지만(miscible), 다른 할로젠화 수소들은 물에 녹는 범위가 정해져 있다. HF와 물은 몇가지 조성이 다른 고체상을 형성하며, 1:1의 조성을 가진 것은 -40℃까지 녹지 않는다.
염산과 같은 할로젠화 수소산과 다르게, HF는 수용액에서 pKa=3.18인 유일한 약산이다. HF가 수용액에서 약산인 이유는 H-F 결합이 HCl, HBr, HI보다도 매우 극성 결합이기 때문이다. 이런 행동을 설명하는 것은 어렵지만 HF, 물, 플루오린화 음이온이 뭉쳐다니는 경향이 있다. 비록 약산이지만 HF는 매우 부식성이 강해서 유리도 부식시킬 수 있다.
HF는 homoconjugation이라는 성질도 가지고 있다. 이 성질은 HF가 플루오린 음이온을 받아 이플루오린화 이온bifluoride ion(HF2-)을 형성하는 것이다.
건조한 HF는 전하수가 작은 플루오린화 금속을 천천히 녹인다. 많은 단백질과 탄수화물도 건조한 HF에 녹고, 다시 회수될 수 있다. 대부분의 플루오린이 없는 무기화합물은 HF에 녹기보단 반응을 한다.
플루오린화 금속Metal fluorides

NaF의 암염 구조 : 노란색이 플루오린 음이온, 보라색이 소듐(나트륨)이다. 등전하를 가지고 있지만 플루오린의 핵전하가 작아서 플루오린이 크다.
플루오린화 금속Metal fluorides은 다른 할로젠화 금속과 비슷하지만 더 이온성이 강하다. 일반적으로 다른 할로젠(염소, 브로민, 아이오딘)은 결합을 형성하거나 산화물을 만들 때 플루오린을 제외한 자기들끼리 비슷하다. 플루오린염과 산화물 결정 구조는 종종 이름을 공유한다.
플루오린화 금속은 금속의 전하에 따라 넓은 경향을 보여준다. 금속 산화수가 +3이거나 그보다 낮으면 플루오린과 이온 결합을 형성한다. 금속의 전하가 +5이거나 그 이상이면 공유결합을 형성한다. 결합의 다양성은 물리학적으로 시사하는 바가 있다:플루오린화 금속은 실온에서 고체, 액체, 기체상으로 존재할 수 있다. 플루오린화물의 용해도는 다양하지만 금속 이온의 전하가 증가하면 용해도가 감소하는 경향이 있다.
낮은 산화수를 갖는 플루오린화 금속
알칼리 금속은 일플루오린화물(monofluoride)을 형성한다. 모두 물에 녹으며 NaCl과 같은 구조를 가진다. 플루오린화 음이온이 염기성이 크기 때문에 많은 플루오린화 알칼리금속은 화학식 MHF2인 이플루오린화물(bifluoride)을 형성한다. 다른 일플루오린화물은 오직 플루오린화 은(I)과 플루오린화 탈륨(I)만이 있다. 둘 다 매우 물에 잘 녹는다.
일플루오린화물과는 다르게 이플루오린화물(difluoride) 물에 잘 녹거나 녹지 않는다. 알칼리토금속이 형성하는 이플루오린화물은 물에 녹지 않는다. 그와는 반대로 염화 알칼리토금속은 물에 녹는다. 몇몇 이플루오린화 전이 금속(transition metal difluorides)이 있는데, 구리(II)나 니켈(II)은 물에 잘 녹는다. 많은 이플루오린화물은 이플루오린화 칼슘으로 부르는 형석의 구조인데, 금속 양이온을 중심으로 9개의 플루오린이 둘러싸고 있다. 어떤 이플루오린화물은 사면체 금홍석(rutile) 구조를 가진다.
이플루오린화 베릴륨(Beryllium difluoride)은 다른 이플루오린화물과는 다르다. 일반적으로 베릴륨은 공유결합을 형성하려는 경향이 있다. BeF2 는 SiO2(쿼츠)와 유사한 점이 많다. BeF2 는 무정형인 유리와 비슷한 구조를 가질 수도 있다. BeF2 는 다른 알칼리토금속과는 다르게 물에 매우 잘 녹는다. 하지만 BeF2 는 수용액에서 전기전도도는 매우 낮다.
| 이플루오린화물의 결정형과 비결정형 | |
 |
 |
| 강하고 안정한 형석의 구조 | 이플루오린화 베릴륨의 무정형 구조(간략히 그린 것이며, 이차원으로만 그린 것) |
철, 비스무트, 희토류 원소와 알루미늄과 스칸듐과 주기율표에서 같은 세로줄에 있는 많은 금속은 삼플루오린화물(trifluorides)을 형성한다. 희토류 원소의 삼플루오린화물과 비스무트는 YF3구조를 가진다. 플루토늄, 사마륨, 란탄넘의 삼플루오린화물은 LaF3 구조를 가진다. 삼플루오린화 철과 갈륨은 삼산화레늄rhenium trioxide과 비슷한 FeF3구조를 가진다. 삼플루오린화, 삼염화, 삼브로민화 금은 이온 구조지만 휘발성이 있다. 삼플루오린화 알루미늄은 높은 녹는점을 가지며 기체상은 단분자형태지만 다른 삼할로젠화 알루미늄은 낮은 녹는점과 휘발성이 있으며 기체상에서 선형 고분자 형태이다. 삼플루오린화물은 물에 녹지 않으며, 몇몇 다른 용매에는 녹을 수 있다.
| 전이 금속 25-29번의 플루오린화물 | ||||
 |
 |
 |
 |
 |
| 이플루오린화 망가니즈 Manganese difluoride |
삼플루오린화 철 Iron trifluoride |
이플루오린화 코발트 Cobalt difluoride |
이플루오린화 니켈 Nickel difluoride |
이플루오린화 구리 Copper difluoride |
높은 산화수를 갖는 플루오린화 금속

ZrF4 , 사플루오린화물의 구조
사플루오린화물(tetrafluorides)은 이온 결합과 공유 결합이 섞여있는 것을 보여준다. 지르코늄, 하프늄과 많은 악티늄족은 사플루오린화물을 형성한다. 녹는점은 약 1000℃이다. 사플루오린화 티타늄과 주석은 고분자이며 녹는점이 400℃이하이다(하지만 사염화물은 실온에서 액체이다). 사플루오린화 바나듐은 주석과 구조가 비슷하지만 150℃에서 분해되어 삼플루오린화물이 된다. 이리듐, 백금, 팔라듐, 로듐의 사플루오린화물은 한개의 금속 원자가 네개의 플루오린과 결합되어 있는데, 두개는 공유하고 두개는 공유하지 않는다. 녹는점은 300℃이하이다. 사플루오린화 망가니즈는 고체로 70℃에서 분해된다. 사플루오린화 저마늄은 실온에서 기체이다.
오플루오린화물과 더 많이 플루오린이 있는 금속은 모두 공유결합이며 휘발성이 있다. 플루오린을 산소로 치환했을 때의 성질과는 대비된다. 산소는 약한 산화제이며, 천성적으로 공유결합을 형성하려고 하지만 오직 네 개의 금속과만 분자를 형성한다(칠산화 망가니즈manganese heptoxide, 칠산화 테크네튬technetium heptoxide, 사산화 루테늄ruthenium tetroxide, 사산화 오스뮴osmium tetroxide). 플루오린은 12개의 금속과 분자를 형성하는데 작은 크기와 이온일 때의 전하가 -1이기 때문에 산소가 할 수 있는 것 보다도 더 많은 플루오린화물을 형성할 수 있다.
주기율표에서 같은 세로줄에 있는 바나듐, 나이오븀, 탄탈럼은 가장 높은 산화수인 +5를 가질 수 있다. 오플루오린화물을 형성할 수 있다. 비스무트는 휘발성이 있는 오플루오린화물을 형성하는데 강력한 플루오린화제이다. 고체상에서는 고분자로 존재한다. 알칼리 금속과 섞이면 육플루오린화비스무트 염, M[BiF6]을 만들 수 있다. 우라늄은 육플루오린화물을 형성하고, 두가지 오플루오린화물 구조를 가진다. 실온에서는 (alpha) 형태로 오플루오린화 비스무트와 같은 구조지만, 기체상에서 UF5는 사각 피라미드 구조이다.
| 오플루오린화 비스무트의 고분자 구조 | |
  |
  |
| (BiF5)n 사슬의 구조 | 사슬을 쌓는 것(Packing of chains) |

육플루오린화 우라늄이 유리관 안에 있다.
육플루오린화물을 형성하는 금속은 주기율표 가운데에 있는 9가지 금속인 몰리브데넘, 테크네튬, 루테늄, 로듐, 텅스텐, 레늄, 오스뮴, 이리듐, 백금과 92~94번인 우라늄, 넵투늄, 플루토늄이 형성한다. 실온에서는 육플루오린화 텅스텐tungsten hexafluoride 은 기체이다. 육플루오린화 몰리브데넘Molybdenum hexafluoride과 육플루오린화 레늄rhenium hexafluoride 은 액체이다. 나머지는 휘발성이 있는 고체이다. 육플루오린화 금속은 플루오린을 방출하려는 경향이 있어서 산화제이다. 그 예로 육플루오린화 백금platinum hexafluoride은 산소와 제논을 산화시키는 물질로 처음으로 발표되었다. 육플루오린화 폴로늄은 아직 연구가 덜 되었다.
레늄은 칠플루오린화물을 형성하는 유일한 금속으로 알려졌다.
비금속 화합물

아이오딘(보라색)은 주위에 7개의 플루오린(노란색)과 화합물을 형성할 수 있다.
플루오린화 비금속 물질은 휘발성이 있는 화합물이고 결합에 있어서 옥텟 규칙을 따르지 않는다. 삼플루오린화 붕소는 중심 붕소 원자에 6개의 전자만을 가진다. 하지만 2주기 원소가 플루오린과 화합물을 형성할 때는 옥텟 규칙을 따른다 : 사플루오린화 탄소carbon tetrafluoride, 삼플루오린화 질소nitrogen trifluoride, 이플루오린화 산소oxygen difluoride. 2주기 밑에서는 옥텟 규칙보다도 더 많은 전자를 수용해서 오플루오린화 인phosphorus pentafluoride을 형성하기도 한다. 이들의 반응성은 다양해서 육플루오린화 황은 반응서이 없고, 삼플루오린화 염소는 플루오린 자체보다도 반응성이 강하다.
- 삼플루오린화 붕소Boron trifluoride는 분자가 평면에 있다. 전형적인 Lewis 산이며, 암모니아나 플루오린화 음이온과 같은 Lewis 염기와 반응한다.
- 사플루오린화 탄소Carbon tetrafluoride와 사플루오린화 실리콘silicon tetrafluoride은 정사면체 구조를 가진다. CF4 는 반응성이 없고 안정하지만, SiF4 는 약한 Lewis 산이다.
- 질소족은 플루오린화물의 반응성과 산성도는 밑으로 내려갈 수록 강해진다. 질소는 오플루오린화물을 형성하지 않고 사플루오린화암모늄 양이온, NF+
4을 형성하여 질소의 산화수가 +5가 된다. - 산소족은 비슷한 성질을 가진다. 육플루오린화물은 산소를 제외한 산소족의 밑으로 내려갈 수록 산성도가 강해진다.
- 할로젠은 모두 일XF, 삼XF3, 오플루오린화물XF5을 형성한다. 칠플루오린호물은 아이오딘iodine heptafluoride이 알려져 있다. 염소와 브로민의 칠플루오린화물은 알려져있지 않지만 ClF+
6, BrF+
6은 존재한다. 많은 플루오린화 할로젠들은 강력한 플루오린화제이다. 삼플루오린화 염소Chlorine trifluoride는 반응성이 매우 크고 폭발성이 있다.
몇몇 중요한 무기산들은 플루오린을 함유하고 있다. 보통 강산들인데 플루오린의 전기음성도가 크기 때문이다. 한 예로 플루오로안티모니 산, fluoroantimonic acid,HSbF6은 알려진 산 중에서 가장 강력한 산으로 알려져 superacid라고 부른다. HF와 SbF5의 혼합물로 pKa가 -31.3이며, 순수한 황산보다 2×1019배 강한 산이다.
비활성 기체 화합물
비활성 기체는 전자 껍질에 전자가 전부 찼기 때문에 반응성이 없고 극단적으로 안정하다. 1960년대까지 비활성기체의 그 어떠한 화학 결합이 없는 것으로 알려졌지만, 1962년 Neil Bartlett가 플루오린과 육플루오린화 백금을 사용해 제논과 반응을 시켰다. 그는 이 화합물을 xenon hexafluoroplatinate이라고 불렀다. Bartlett는 monofluoroxenyl(II) hexafluoroplatinate, [XeF]+[PtF6]–, monofluoroxenyl(II) undecafluorodiplatinate, [XeF]+[Pt2F11]–, and trifluorodixenyl(II) hexafluoroplatinate, [Xe2F3]+[PtF6]–의 혼합물을 합성했을 것이다. Bartlett의 제논의 플루오린화법은 화학의 역사에서 가장 실용적인 실험일 것이다. 1962년 이후에 제논은 플루오린과 바로 반응해서 이, 사플루오린화물을 형성한다.

1962년, 사플루오린화 제논 결정
불활성기체-플루오린 화합물이 만들어지기 시작하면서, 제논은 이런 화합물중에 가장 잘 알려졌다. 이플루오린화 제논xenon difluoride, 사플루오린화 제논xenon tetrafluoride, 육플루오린화 제논xenon hexafluoride과 그 유도체들이 알려졌다. 제논은 몇몇 oxyfluorides를 형성하는데, 육플루오린화 제논을 물과 반응시켜서 xenon oxytetrafluoride, XeOF4,를 얻을 수 있다. 제논 위에 있는 크립톤도 이플루오린화 크립톤krypton difluoride이라는 화합물을 만든다. 저온에서 일플루오린화 크립톤 라디칼과 양이온이 관찰되었다.
2012년에 확인된 가장 무거운 비활성 기체인 라돈도 주기성에 따르면 플루오린을 포함한 산화제와 더 반응을 할 것이다. 플루오린과 반응하여 이플루오린화 라돈radon difluoride이라는 고체 화합물을 만든다고 생각된다. 정확한 조성은 아직 불확실한데, 화합물이 빠르게 붕괴하기 때문이다. 계산에 따르면 이플루오린화 라돈은 다른 비활성기체 화합물과 다르게 이온일 것으로 예측된다.
헬륨, 네온, 아르곤과 같은 가벼운 비활성 기체는 플루오린화물을 만들지 않는다. 하지만 아르곤은 극단적인 조건에서 HF와 반응해 argon fluorohydride를 형성한다. 이 극단적인 조건에 있을 때지만 유일하게 안정한 화합물이다. 아르곤은 또 짧은 시간동안만 존재하는, 준안정한 이원자 분자인 ArF•을 형성하는데, 아르곤 플루오린 레이저에서 사용된다. 네온도 준안정한 화합물인 neon monofluoride, NeF•을 형성한다.
우눈옥튬, 알려진 마지막 18족 원소로, 이플루오린화 우눈옥튬 ununoctium difluoride, UuoF2, 사플루오린화 우눈옥튬ununoctium tetrafluoride, UuoF4을 형성할 것이라 예측하고 있다.
유기화합물
유기플루오린 화합물은 C-F 결합을 가진 화합물을 말한다. 유기화학에서 이 결합은 가장 강한 결합이고 매우 안정하다. 플루오린은 실온에서 탄화수소의 수소를 치환할 수 있다. 반응 후에 분자 크기는 크게 변하지 않는다. 유기플루오린 화합물은 플루오린기체와 바로 반응시켜 합성한다.

'Elements' 카테고리의 다른 글
| 소듐(나트륨), Sodium(Natrium) (2) | 2013.09.21 |
|---|---|
| 네온, Neon (1) | 2012.09.23 |
| 산소, Oxygen (0) | 2012.03.12 |
| 질소, Nitrogen (1) | 2012.01.20 |
| 탄소, Carbon (0) | 2012.01.15 |

