실험 제목 : Distillation & Purification
실험 목적 : 액체의 끓는점과 액체혼합물의 분리방법인 증류에 대한 개념을 배우고, 실험을 통하여 단순증류, 감압증류, 증기증류방법과 각 방법의 원리와 작용에 대해 배운다.
시약 및 기구 : DMF(N,N-dimethylformamide), Ethyl acetate, Salicylic acid, Naphthalene, 250 mL 3-neck rb, 100 mL 1-neck rb, Distillation head, Erlenmeyer flask, Thermometer, 고무마개, Heating mentle, Slidax, Latex tube, Clamp & calmp holder, Stirring bar, Pipette & filler, Vacuum adapter, Ice bath, Separatory funnel, Collector, Lab jack
주의사항
1. 온도는 서서히 올려야 한다.
2. 이음새를 잘 막아 증기가 빠져나가지 않도록 한다.
3. 가열 시 화상에 주의한다.
시약 조사
1. DMF(N,N-dimethylformamide)

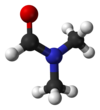
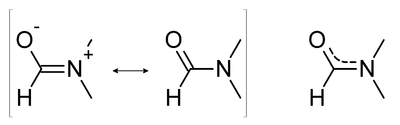
IUPAC name이 N,N-Dimethylmethanamide는 분자식이 (CH3)2NC(O)H, 분자량은 73.09g/mol, 밀도가 0.744 g/cm³, 녹는점 -61℃, 끓는점 153℃인 무색의 투명한 액체이다. DMF는 물과 주요 유기 용매와는 잘 섞이는(miscible) 액체이다. 순수한 DMF는 무취이지만 상하거나 오염되면 물고기 냄새가 나게 된다. DMF는 polar aprotic solvent 로써 SN2 반응에도 많이 이용된다. DMF는 NaOH와 같은 강염기나 HCl과 같은 강산에서는 불안정하며, 온도를 높이면 formic acid와 dimethylamine 으로 가수분해 된다. 그리고 DMF는 다음과 같은 공명구조를 가진다.
그리고 DMF는 암을 유발시키고, 기형아 출산의 원인으로 생각하는 물질이다.
2. Ethyl acetate
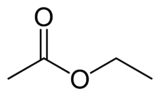

Ethyl acetate는 간단하게 EtOAc로 쓰거나 EA로 쓰며, 분자식은 CH3COOCH2CH3, 분자량은 88.105g/mol, 밀도가 0.897 g/cm³, 녹는점 -83.6℃, 끓는점 77.1℃인 무색이며 특징적인 달콤한 향기를 가진 액체이다. 물에는 8.3g/100mL (20℃) 정도 용해되며 ethanol, aceton, diethyl ether, benzene 등에는 miscible 하다. Ethyl acetate는 ethanol과 acetic acid의 Fischer esterification 반응을 통해 합성된다. 이 방법으로 실온에서 65%의 수득률을 보인다.
CH3CH2OH + CH3COOH ⇌ CH3COOCH2CH3 + H2O
이 반응은 산촉매로 반응속도를 빠르게 할 수 있으며 물을 제거하면 평형이 오른쪽으로 옮겨간다. 값이 싸고 독성이 약하며 기분 좋은 냄새를 가졌기 때문에 Ethyl acetate는 주로 용매나 희석제로써 사용된다. 그리고 원두나 찻잎으로부터 카페인을 제거할 때의 용매로도 사용한다. 실험실에서는 Ethyl acetate는 주로 컬럼 크로마토그래피와 추출할 때 쓰인다. Ethyl acetate는 휘발성이 매우 강하며 낮은 끓는 점을 가지고 있다.
3. Salicylic acid
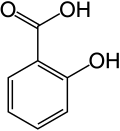
)
Salicylic acid는 다른 두 탄소에 carboxyl acid functional group과 hydroxy functional group이 있는 beta hydroxy acid 이다. 분자식은 C6H4(OH)COOH, 분자량은 138.12 g/mol, 밀도는 1.443 g/cm³, 녹는점 159.0℃, 끓는점은 211℃(20 mmHg)이며 물에 매우 안 녹아 용해도는 0.2g/100mL 인 무색의 결정형 고체이다. 살리실산은 식물의 호르몬으로 작용한다. 살리실산은 생명체 내에서 아미노산인 phenylalanine으로부터 합성된다. 그리고 또 다른 방법으로는 페놀에 NaOH를 가해 sodium phenolate를 만들고 이산화탄소를 100atm, 390K로 공급하면 Kolbe-Schmitt 반응으로 살리실산의 나트륨 염이 만들어지는데, 황산을 가해 살리실산으로 만든다.

그리고 살리실산은 아스피린등 의약품으로써 많이 이용된다.
4. Naphthalene

Naphthalene은 IUPAC name이 bicyclo[4.4.0]deca-1,3,5,7,9-pentene, 분자식 C10H8, 분자량 128.17052 g/mol, 밀도 1.14 g/cm³, 녹는점 80.26℃, 끓는점 218℃, 물에 대한 용해도 약 30mg/L, 공기중에 0.08 ppm(by mass)만 있어도 석탄 타르 냄새가 강하게 나는 흰색의 고체 결정이다. 나프탈렌은 휘발성이 강하며 가연성의 기체를 형성하고 실온에서도 쉽게 승화한다. 1819-1820년에 적어도 두 화학자가 석탄 타르로부터 증류했다고 보고했으며, 1821년 John Kidd는 이 물질의 이름을 Naphthaline 으로 부르자고 했다. 나프탈렌의 화학식은 1826년 Michael Faraday가 밝혀냈으며 1866년에 Emil Erlenmeyer가 두개의 benzene 고리가 붙어 있다는 것을 제안하였고, 3년후 Carl Grabe가 확인하였다. 나프탈렌은 벤젠처럼 electrophilic aromatic substitution을 한다. 대부분의 나프탈렌은 석탄 타르로부터 얻어진다.
실험 원리
Distillation(증류)는 끓는 액체 혼합물의 각각의 물질이 휘발성이 서로 다름을 이용하여 물질을 분리하는 방법이다. 증류는 화학적인 반응이 아닌 물리적인 분리 방법이다. 증류는 여러 곳에 쓰이는데 바닷물로부터 염 등을 제거하여 증류수를 만들 때 쓰이며, 공기를 질소, 산소, 아르곤으로 분리할 때 쓰이며, 발효된 술로부터 증류주를 만들 때 쓰인다.
기원전 2000년경 오늘날의 이라크 지역인 메소포타미아의 바빌로니아에서 초기 증류 장치가 사용되었다. 기원전 500년경 파키스탄에서 알코올의 분리를 위해 사용된 증류 장치가 발굴되기도 하였다. 기원후 1세기 경에 그리스로 증류기술이 전달되면서 이후 그리스에서는 대량의 증류주가 제조되었다. Fractional distillation(분별 증류)는 13세기의 Tadeo Alderotti가 개발했다.
끓는점이란 액체의 증기압이 외부 대기압과 같아지는 점을 말한다. 이상 증류 모델(Idealized distillation model)은 혼합물에서의 어떤 액체의 증기압은 순수한 그 액체의 증기압에 몰분율을 곱한 것과 같다는 Raoult의 법칙과 기체들의 혼합물이 나타내는 압력은 각 기체가 단독으로 용기를 차지할 때의 압력들의 합과 같다는 Dalton의 법칙, 그리고 증기-액체 평형을 따른다.
혼합물에서 끓어나온 특정한 하나의 증기가 차지는 비율은 그 물질이 가지는 전체압에 대한 부분압의 비율과 같다. 따라서 분자간의 힘이 약한 물질은 부분압이 크고 증기 중에 많이 있고, 분자간의 힘이 강한 물질은 부분압이 작고 그만큼 증기 중에 차지하는 비율이 작다.
이상 증류 모델은 benzene과 toluene과 같이 비슷한 화학종에 대해서 정확하다. 물과 ethanol과 같이 Raoult의 법칙과 Dalton의 법칙으로부터 극심한 편차가 있는 경우에는 같이 가열 했을 때 각각의 순수한 물질일 때의 원래의 끓는점보다 낮아져서 같이 끓게 되는 azeotrope가 된다. 모든 액체가 다른 액체와 섞고 가열하면 azeotrope으로 행동하게 된다. 임의의 두 액체를 섞었을 경우 행동을 예측할 수 있는 유일한 방법은 증기-액체 평형을 조사하는 것이다. 따라서 액체 혼합물이 azotrope가 되기 때문에 증류로 혼합물로부터 각각의 물질을 순수한 상태로 완벽하게 정제하는 것은 불가능하다.
증류의 방법에는 simple distillation(단순 증류), fractional distillation(분별 증류), steam distillation(증기 증류), vacuum distillation(감압 증류), air-sensitive vacuum distillation, short path distillation 등이 있다.
먼저 단순 증류는 뜨거운 증기가 생성되면 condenser로 가게 되고 응축되어 collecter에 모인다. 따라서 이 방법으로 증류한 것은 순수하지 않다. 증류된 물질의 조성은 주어진 온도와 압력에서의 증기의 조성과 같으며 Raoult의 법칙으로부터 계산할 수 있다. 따라서 단순 증류는 끓는점 차이가 25℃이상 정도로 많이 나는 경우에만 사용하거나, 액체를 기화성이 없는 고체나 오일로부터 분리할 때 사용한다. 이 경우 기화성이 없어서 무시할 수 있을 정도로 증기압이 적고 Raoult의 법칙을 적용하지 않아도 된다. 그리고 충분히 우리가 원하는 만큼 순수한 물질을 증류로부터 얻을 수 있다.
하지만 많은 경우 Raoult의 법칙을 고려해야할만큼 혼합물들의 끓는점이 가까이 있다. 분별 증류는 끓는점이 가까이에 있는 혼합물을 각 성분별로 분리하는 것이다. 각 화학종들은 자신의 끓는점까지 온도를 가열하면 몇몇 화학종들은 기화되어 분리된다. 일반적으로 끓는점 차이가 25℃이하일 때 분별 증류를 사용하고, 25℃이상일 때는 단순 증류를 사용한다. 물과 에탄올의 혼합물을 증류한다고 하자. 에탄올은 78.4℃에서 끓고 물은 100℃에서 끓는다. 그래서 가열을 하게 되면 가장 휘발성이 큰 물질이 증기중에 가장 많을 것이다. 하지만 어떤 혼합물은 azotrope에서 나온 것이다. 96%의 에탄올과 4%의 물이 섞인 혼합물을 78.2℃에서 끓게 된다. 이런 이유로 물과 에탄올 혼합물에서는 절대로 순수한 에탄올을 얻을 수 없다.
증기 증류는 aromatic compound처럼 온도에 민감한 물질을 증류할 때 쓰인다. 많은 유기 화합물들은 높은 온도에서 분해되는 경향이 있다. 따라서 분리, 정제를 위한 일반적인 증류 방법은 선택을 할 수 없다. 그래서 물 또는 수증기를 증류 장치안에 포함하게 된다. 물 또는 수증기를 첨가함으로써 물질들을 원래의 끓는점보다 더 낮은 온도에서 기화한다. 만약 물질이 열에 대해서 매우 민감할 경우, 증기 증류와 함께 감압 증류를 합치기도 한다. 증류 후에는 기체를 응축시키고, 물과 유기화합물의 2개의 상으로 분리하여 얻어낸다. 두개의 섞이지 않는 액체가 각각의 온도에 해당하는 증기압을 독립적으로 발휘하기 위해 교반시키면서 가열을 한다고 하자. 그러면 전체 계의 증기압이 증가한다. 두개의 섞이지 않는 액체의 부분압의 합이 대기압을 넘어서면 끓게 된다. 이런 방법으로, 많은 유기화합물은 물에 녹지 않고 분해가 일어나지 않는 온도에서 순수하게 분리될 수 있다. 예를 들어 bromobenzene은 끓는점이 156℃이지만 물과 함께 섞고 끓이면 끓는점이 95℃가 된다. 즉, 원래의 끓는점보다 무려 61℃나 낮은 온도에서 끓게 된다.
감압 증류는 용액에 열을 가하지 않아도 될 수 있다는 특징이 있다. 그래서 감암 증류는 low temperature distillation이라고 부르기도 한다. 감압 증류는 액체가 대기압 아래에서 너무 높은 끓는점을 가지거나 대기압아래 끓는점에서 화학적인 변화가 일어날 때 사용한다. beta carotene과 같이 온도에 민감한 물질에 손상을 주지 않고 용매로부터 분리하고 싶을 때 역시 감압 증류가 필요하다. 그리고 감압 증류가 증기 증류와 구별되는 또 하나는 증기 증류에 비해서 적은 양의 잔류물을 남긴다는 점이다.
'Organic Chemistry > Organic Chemistry Exp.' 카테고리의 다른 글
| Grignard Reaction (그리나르 반응) (4) | 2010.12.15 |
|---|---|
| Electrophilic Aromatic Substitiution (친전자성 방향족 치환 반응) (3) | 2010.12.14 |
| Recrystallization : Acid - base properties (2) | 2010.09.25 |


