
|
과망간산 칼륨, Potassium permanganate | |
| IUPAC 명명법 | Potassium manganate(VII) 과망가니즈산 포타슘 |
| 관용명 | Potassium permanganate Potassium manganate(VII) Chameleon mineral Condy's crystals Permanganate of potash |
| 분자식 | KMnO4 |
| 분자량 | 158.034 g/mol |
| 밀도 | 2.703 g/cm3 |
| 녹는점 | 240 °C, 513 K (열분해) |
| 물에 대한 용해도 | 6.38 g/100 mL (20 °C) 25 g/100 mL (65 °C) 알코올이나 다른 유기용매에선 분해된다. |
| Risk Phrases | R8 : 가연성의 물질과 접촉시 화재를 일으킬 수 있음 R22 : 삼킬 경우 해로움 R50/53 : 수중 생명체에 매우 독성이 강하고, 오랜 기간 동안 수중 생태계에 영향을 미칠 수 있음 |
| Safety Phrases | (S2 : 아이들이 닿지 않는 곳에 둘 것) S60 : 위험 폐기물로 분류해서 버리고 보관할 것 S61 : 자연으로의 방출을 피할 것 |
과망간산 칼륨, 과망가니즈산 포타슘, Potassium permanganate은 KMnO4의 화학식을 가지는 무기 화합물이다. K+와 MnO4-의 염이다. 예전에는 강력한 산화제로 permanganate of potash 또는 Condy's crystals로 알려졌다.물에 녹으면 강한 보라색의 용액을 만들고, 물을 증발시켜 날릴 경우 삼각 기둥 모양의 보라-까만 색의 반짝이는 결정이 남는다. 2000년에 전세계적으로 약 30,000톤이 생산되었다. 이 화합물에서 망가니즈(망간)는 +7의 산화수를 가지고 있다.
과망간산 칼륨은 산업적으로 연망간석(Pyrolusite) 광물로부터 얻을 수 있는 이산화 망간(MnO2)으로부터 만들어진다. MnO2 를 KOH 용액에 녹이면서 가열한 공기를 주입하거나 산소를 공급할 수 있는 KNO3나 KClO3를 공급하면 Potassium manganate(K2MnO4)를 얻는다.
Potassium manganate를 염기성 용액에서 전기 분해를 하거나, 이산화 탄소 존재 하에서 초록색이 없어질 때까지 용액을 끓이면 과망간산 칼륨을 얻는다.
또는
2 MnO42– + Cl2 → 2 MnO4– + 2 Cl
과망간산 칼륨은 불용성의 이산화 망간으로부터 필터를 통해서 분리할 수 있다.
과망간산 염은 Mn2+ 이온이 있는 용액을 강력한 산화제인 PbO2나 NaBiO3로 처리를 하면 얻을 수 있다.
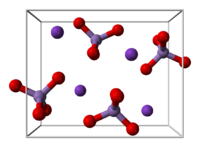
과망간산 칼륨은 사방정계(orthorhombic) 결정을 만들고, 각 상수는 a=910.5 pm, b=572.0pm, c=742.5 pm 이다.
MnO4- 는 중심이tetrahedral이고, Mn-O 간 거리는 1.62 Å이다.
반응

KMnO4를 물에 녹인 용액
● 분석 화학
과망간산 칼륨은 수용액 시료에 있는 산화가 가능한 유기 물질의 총량을 정량적으로 결정할 수 있다. 이렇게 정한 값을 permanganate value 라고 한다. 분석화학에서는 표준화한 KMnO4 수용액을 산화-환원 적정 반응에서의 산화 적정 시약으로 사용한다.
● 유기 화학
묽은 KMnO4 용액은 alkene을 diol로 전환시킨다. 이러한 원리를 이용해 분자에서 이중결합 또는 삼중결합이 존재 유무를 정성적으로 알아낼 수 있다. 이 방법은 Baeyer's reagent 라고 부른다. 그러나, 과망간산 칼륨은 너무나 강력한 산화제이기 때문에 다양한 작용기와 반응을 할 수 있기 때문에 브로민이 불포화 정도를 정량 분석에 쓰인다.
산성 조건에서는 이중 결합이 분해되어 적당한 Carboxylic acid를 만들 수 있다.
CH3(CH2)17CH=CH2 + 2 KMnO4 + 3 H2SO4 → CH3(CH2)17COOH + CO2 + 4 H2O + K2SO4 + 2 MnSO4
과망간산 칼륨은 aldehyde를 carboxylic acid로 산화시킬 수 있다. 아래의 반응은 n-heptanal이 heptanoic acid가 되는 반응이다.
5 C6H13CHO + 2 KMnO4 + 3 H2SO4 → 5 C6H13COOH + 3 H2O + K2SO4 + 2 MnSO4
심지어 benzene에 붙어 있는 alkyl 기가 산화될 수 있어서 toluene이 benzoic acid가 된다.
5 C6H5CH3 + 6 KMnO4 + 9 H2SO4 → 5 C6H5COOH + 14 H2O + 2 K2SO4 + 6 MnSO4
OH 기를 많이 가지고 있는 Glycol이나 polyol은 과망간산 칼륨과 격렬히 반응한다. 설탕또는 NaOH 수용액에 과망간산 칼륨을 첨가하면, chemical chameleon 반응을 일으켜서, 망가니즈의 산화 상태에 따른 색이 매우 다양하게 변화하게 된다. 이런 반응들을 이용해 과망간산 칼륨은 생존 키트(survival kit)에서 불을 일으키는 도구로 사용된다. 예를 들어, 과망간산 칼륨과 글리세롤 또는 포도당을 혼합하게 되면 즉시 발화하게 된다.
● 산과의 반응
황산과 과망간산의 반응은 폭발성이 있는 Mn2O7을 만든다. HCl과는 염소 기체를 만들게 된다. 산화 환원의 반응으로부터 생겨난 Mn을 함유한 생성물은 pH에 따라 달라지게 된다. 산성 용액에서는 엷은 핑크색을 띄는 Mn2+으로 환원되고, 중성 용액에서는 과망간산은 3e− 만큼 환원 되어 Mn이 +4의 산화수를 가지는 MnO2로 환원 된다. 염기성 용액에서는 초록색의 Mn이 +6의 산화수를 가지는 K2MnO4가 된다.
포화 황산과 과망간산 칼륨을 반응시키면 아무런 반응이 나타나지 않는 것 처럼 보인다. 하지만 용액 위에 알코올을 적신 종이를 올려놓으면 발화한다. 과망간산 칼륨과 황산이 반응해 오존을 만들고, 오존은 알코올을 빠르게 산화시킬 수 있는 산화력을 가졌기 때문에 불이 나게 된다. 그리고 이 반응은 폭발성의 Mn2O7를 생성하기 때문에 매우 조심해야만 한다.
● 광분해
과망간산 칼륨은 빛에 노출되면 분해된다.
2 KMnO4 → K2MnO4 + MnO2(s)+O2
● 취급법
산화제는 검은 갈색을 띄는 MnO2를 만드는데, 피부, 종이, 옷과 같은 유기물질에 빠르게 착색된다. 이런 염색 효과를 TLC에 사용한다. 이런 산화 환원 반응을 예술적인 목적으로 빠르게 표백한 종이를 만들기 위해서 시약을 사용하기도 한다.
'Compounds' 카테고리의 다른 글
| 벤조산, Benzoic acid (3) | 2012.03.11 |
|---|---|
| EDTA, Ethylenediaminetetraacetic acid (0) | 2011.06.13 |
| Dichloromethane, Methylene chloride (0) | 2011.04.26 |
| TCPO (4) | 2011.04.21 |
| Acetanilide, 아세트아닐라이드 (0) | 2011.04.21 |


