알지 못하는 유기화합물의 구조를 스펙트럼으로 분석하기 전에 분자식으로부터 문제를 단순하게 만드는 것이 필요하다. 이 글에서는 분자식과 분자식으로부터 알 수 있는 정보를 다루고자 한다.
원소분석 Elemental analysis
분자식molecular formula를 결정하기 전에 이 분자에 어떤 원소가 있는지 알아내는 것이 중요하다. 분자식을 결정하기 까지 보통 세 개의 과정을 거친다.
1. 정성 원소 분석Qualitative elemental analysis 는 어떤 원소가 존재하는지 조사하는 것이다. C, H, O, N, S, Cl 등이 있는지 없는지 정하는 과정이다.
2. 정량 원소 분석Quantitative elemental analysis(microanalysis)는 분자 안의 원소의 상대적인 양(비)를 조사하는 것이다.
이 두 과정을 합치면 실험식empirical formula가 된다.
3. 분자량molecular mass 결정
마지막으로 분자량을 결정하고 나면 분자식이 구해진다. 보통 실험식을 구하는 과정인 정성, 정량 원소분석에 연소를 통해서 구한다.
분자식 Molecular formula
분자량과 실험식을 알고나면 분자식을 구할 수 있다. 실험식과 분자량이 같으면 실험식이 바로 분자식이 된다. 하지만 꽤 많은 경우에 실험식은 분자량보다 작을 때가 많다. 예를 들어 에테인Ethane을 정량 원소 분석을 통해 실험식을 구하면 CH3로 얻어진다. 하지만 분자량은 30 으로 결정된다. 에테인의 실험식의 무게는 15인데, 분자량은 30이다. 그렇다면 에테인의 분자식은 2(CH3)가 되어야하고, 다시 쓰면 C2H6이다.
수소모자람 지수 Index of hydrogen deficiency
모르는 화합물이더라도 분자식만 안다면 꽤 많은 정보를 얻어낼 수 있다. 그 정보는 일반적인 분자식으로부터 나온다.
CnH2n+2 |
|
|
cycloalkane, alkene | CnH2n | |
CnH2n-2 |
고리나 π 결합이 하나 생길 때마다 분자식에서 수소가 2개씩 빠지는 것을 볼 수 있다. 삼중결합 하나 당 분자식에서는 네 개의 수소가 빠진다.
화합물에 탄소, 수소가 아닌 다른 원소가 있을 때는 탄소와 수소의 비가 달라질 수 있다.
15족 |
16족 |
17족 |
탄소 대신 N, P, As, Sb, Bi의 15족 원소가 한 개 있을 때마다 수소를 1개씩 더 해준다. |
탄소 대신 O, S, Se, Te의 16족 원소가 한개 있을 때 수소의 변화는 없다. |
탄소 대신 F, Cl, Br, I의 17족 원소가 한 개 있을 때마다 수소는 1개씩 빼준다. |
C2H6 C2H7N C2H8N2 C2H9N3 |
C2H6 C2H6O C2H6O2 C2H6O3 |
C2H6 C2H5F C2H4F2 C2H3F3 |
알케인alkane을 기준으로 해서 분자식에 수소가 얼마나 모자란지 알아보면 이중 결합, 삼중 결합 혹은 고리가 몇개나 있을지 예상할 수 있게 된다. 이를 수소 모자람 지수 Index of hydrogen deficiency(또는 불포화 지수, unsaturation index)라고 한다. 수소모자람 지수는 π 결합과 고리의 수를 알려준다. 만약 index 값이 1이 나왔다면 이 화합물엔 이중결합이 한 개 있는 것이 된다. Index 값이 2 라면 삼중 결합이 1 개 있거나, 이중 결합이 2개 있거나, 이중 결합 1개와 고리가 1개 있다는 것이다. 또 벤젠의 경우에는 이중 결합이 3개, 고리 화합물이므로 index 값이 4가 나온다. 그래서 어떤 분자식의 index 값이 4 이상이 나왔다면 벤젠이 있다는 것을 의미하는 경우가 많다.
수소 모자람 지수, Index of hydrogen deficiency를 정하는 법은 아래 순서를 따르면 된다.
1. 주어진 분자식과 같은 탄소 수를 가지는 포화, 고리가 아닌 탄화수소의 분자식을 결정하자.
2. 주어진 분자식에서 탄소, 수소가 아닌 원소에 맞추어서 포화 탄소수소의 분자식을 바꿔주자. 15족 원소가 1개 있을 때마다 수소를 1개씩 더해주고, 17족은 1개씩 빼주자. 16족은 변화가 없다.
3. 포화 탄화수소의 분자식에서 주어진 분자식을 뺀다. 그러면 두 화합물의 수소 개수의 차이가 나타난다.
4. 이 수소의 차이를 2로 나누어준다. 이것이 수소 모자람 지수가 된다.
어떤 화합물의 분자식이 C7H14O2 이다. 이 화합물의 수소 모자람 지수를 위의 순서대로 구해보자.
1. 탄소가 7개인 포화 탄화수소의 분자식은 C7H16이다.
2. 산소가 두개 있으므로 포화 탄화수소의 분자식의 수소의 개수는 바뀌지 않아 C7H16O2이다.
3. 이 두 화합물의 차이 = C7H16O2 - C7H14O2 = H2이다.
4. 이 값을 2로 나누면 1이 된다.
따라서 C7H14O2에는 이중 결합이 한 개 있거나 고리가 하나 있는 화합물이다.
13의 규칙, The rule of thirteen
분자식으로부터 얻어낼 수 있는 정보가 있지만, 분자식은 모르고 분자량molecular mass만 알 때도 얻어낼 수 있는 정보가 있다. 이를 13의 규칙, The rule of thirteen (해당하는 우리말이 없어 직역합니다)이라 한다.
Rule of thirteen의 첫번째는 탄소와 수소만 있는 기준이 되는 분자식base formular을 만드는 것이다. 주어진 분자량 M을 13으로 나누어, 정수 n과 나머지 r로 표현하자. 즉,
그러면 기준이 되는 분자식base formular은 아래와 같다.
CnHn+r
이 식이 바로 분자량 M을 가지는 분자가 가질 수 있는 탄소와 수소의 조합이다. 이 식에서 바로 수소 모자람 지수, Index of hydrogen deficiency를 정할 수 있다. 수소 모자람 지수는 unsaturation index이라고도 하며, 이를 U로 표현하면 아래와 같은 식이 된다.
위 식은 위에서 수소 모자람 지수를 구한 방식대로 구하면 구할 수 있다. 우리가 알고자하는 이 화합물에 탄소와 수소로만 이루어져 있다는 보장은 없다. 즉 산소나 질소, 염소와 같은 원소도 있을 수 있다. 만약 산소 O를 넣기 위해서 산소의 분자량이 16이므로, 16과 같은 분자량을 가지는 CH4를 빼고 넣어야한다. 또 U값이 변하게 된다. 이를 정리한 것이 아래의 표가 된다.
더하는 원소 |
빼는 분자식 |
U의 변화량 |
더하는 원소 |
빼는 분자식 |
U의 변화량 |
C |
H12 |
7 |
35Cl |
C2H11 |
3 |
H12 |
C |
-7 |
79Br |
C6H7 |
-3 |
O |
CH4 |
1 |
79Br |
C5H19 |
4 |
O2 |
C2H8 |
2 |
F |
CH7 |
2 |
O3 |
C3H12 |
3 |
Si |
C2H4 |
2 |
N |
CH2 |
0.5 |
P |
C2H7 |
2 |
N2 |
C2H4 |
1 |
I |
C9H19 |
0 |
S | C2H8 | 2 | I | C10H7 | 7 |
이를 토대로 분자량이 94인 분자가 가질 수 있는 화학식을 생각해보자. 먼저 13의 규칙을 통해 n과 r을 구하면,
그러면 기준이 되는 분자식base formular은 아래와 같다.
C7H10
이 식의 수소 모자람 지수는,
Index 값이 3이 나왔다. 다양한 화학식을 가질 수 있다.
하지만 오른쪽 그림처럼 고리가 1개, 이중 결합이 2개인 구조를 생각할 수 있다.
이런 구조를 생각할 수 있지만, 다른 원소가 포함된 것도 있을 수 있다.
예를 들어 산소 O가 있는 분자를 생각하자.
위 표에서 산소O를 넣으면 CH4를 분자식에서 빼고 U도 값이 1이 증가한다.
O를 넣고 CH4를 뺀 분자식은 C6H6O이다.
이 분자식의 U 값은 3에서 1이 증가해 4가 된다.
U가 4 이상일 때는 벤젠 고리가 있을 가능성이 있다고 했으므로, 벤젠 고리가 있는 C6H6O을 상상하면 다음과 같은 분자식을 얻을 수 있다.
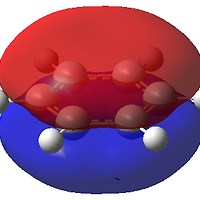
왼쪽 그림에 있는 분자는 분자식이 C6H6O이면서 분자량은 94, U=4 인 분자가 된다.
오로지 분자량으로만 페놀phenol을 유추할 수 있는 것이다.
물론 이 방법으로 분자량이 94인 분자는 페놀이다라고 단언할 수 없고, 다른 실험 자료가 뒷받침 되어야한다.
'Organic Chemistry' 카테고리의 다른 글
| 휘켈 규칙, Huckel's Rule (0) | 2014.11.14 |
|---|---|
| Diels-alder reaction (0) | 2014.10.14 |
| 벤젠의 공명 구조, Resonance Structure of Benzene (1) | 2014.08.08 |
| 방향족 화합물, Aromatic Compound (0) | 2014.07.31 |
| 알카인의 할로젠첨가 반응, Halogenation of Alkyne (0) | 2014.07.26 |